

【题目】磷酸铁(FePO42H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤.反应加热的目的是_____.
(2)向滤液中加入一定量H2O2氧化Fe2+,为使滤液中的Fe2+完全被H2O2氧化成Fe3+,下列实验条件控制正确的是_____(填字母编号).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节溶液pH=7
(3)往含有Fe3+的溶液中加入一定量的Na2HPO4溶液(溶液显碱性),搅拌、过滤、洗漆、干燥得到FePO42H2O.若反应得到的FePO42H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为_____.
(4)实验过程中用H2O2氧化Fe2+之前,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式为:CrO![]() +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、_____和_____.
②若滴定x mL含Fe2+的滤液消耗a molL﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=_____ molL﹣1.
【答案】加快铁和稀硫酸的反应速率 A、B Fe(OH)3 用蒸馏水洗净 用K2Cr2O7标准溶液润洗2~3次 ![]() molL﹣1
molL﹣1
【解析】
(1)根据影响化学反应速率的因素分析;
(2)向滤液中加入一定量H2O2氧化Fe2+,为使滤液中的Fe2+完全被H2O2氧化成Fe3+,考虑H2O2的分解,温度不能太高,结合具体的操作分析;
(3)根据碱性条件下,Fe3+会变成Fe(OH)3,且FePO42H2O为难溶于水的米白色固体,最终得到FePO42H2O固体呈棕黄色进行判断;
(4)根据滴定原理和实验步骤进行解答。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热可以加快铁和稀硫酸的反应速率,故答案:加快铁和稀硫酸的反应速率;
(2) A. H2O2具有强氧化性,能把滤液中的Fe2+完全氧化成Fe3+,所以需加入适当过量的H2O2溶液,故A正确;
B.缓慢滴加 H2O2溶液并搅拌,避免局部反应带来的干扰,使溶液中离子间反应更充分,故B正确;
C. H2O2不稳定,受热易分解。加热,能促进化学反应的速率,考虑到H2O2受热易分解,适当加热可以,但温度不能太高,故C错误;
D.用氨水调节溶液pH=7,此时溶液中已经生成Fe(OH)3沉淀,操作目的是把氧化的Fe2+变为Fe3+,并不是除杂,故D错误;
故答案为:A、B;
(3)往含有Fe3+的溶液中加入一定量的Na2HPO4溶液(溶液显碱性),最终得到FePO42H2O固体呈棕黄色,由于FePO42H2O是难溶于水的米白色固体,可以判断掺入了杂质,考虑到碱性条件下可能产生Fe(OH)3杂质,颜色比较符合,所以磷酸铁中混有的杂质可能为Fe(OH)3,故答案为:Fe(OH)3;
(4)①将标准液装入滴定管前,需要检漏,先用蒸馏水洗净滴定管,再用K2Cr2O7标准液润洗2~3次,故答案为:用蒸馏水洗净;用K2Cr2O7标准溶液润洗2~3次;
②由电子守恒原理可得反应关系为:Cr2O72-![]() 6 Fe2+,若滴定xmL含Fe2+的滤液消耗a molL﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=6c(Cr2O72-)=
6 Fe2+,若滴定xmL含Fe2+的滤液消耗a molL﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=6c(Cr2O72-)=![]() mol/L,故答案为:
mol/L,故答案为:![]() molL﹣1。
molL﹣1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下向 0.l mol/L 的NaClO 溶液中通入 HF 气体,随反应进行(不考虑HClO分解),溶液中lg![]() ( A 代表ClO 或F) 的值和溶液pH 变化存在如图所示关系,下列说法正确的是
( A 代表ClO 或F) 的值和溶液pH 变化存在如图所示关系,下列说法正确的是
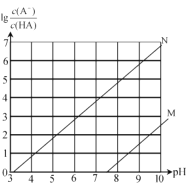
A.线N 代表lg![]() 的变化线
的变化线
B.反应ClO-+HF HCIO+F- 的平衡常数数量级为 105
C.当混合溶液pH= 7 时,溶液中c(HClO) = c(F- )
D.随HF 的通入,溶液中c(H+) c(OH- )增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴与氢气在一定条件下反应的热化学方程式如下:
①Br2(g)+H2(g)2HBr(g) △H=-Q1kJ·mol-1
②Br2(l)+H2(g)2HBr(g) △H =-Q2kJ·mol-1
下列说法正确的是
A.Q1<Q2
B.1molHBr(g)具有的能量大于1molHBr(l)具有的能量
C.相同条件下,Cl2(g)+H2(g)2HCl(g) △H >-Q1kJ·mol-1
D.向1molBr2(g)中加入1molH2(g)在该条件下充分反应,放出Q1kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的有机产物中有且仅有一种结构的是
A.异戊二烯![]()
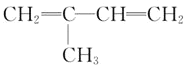
![]() 与等物质的量的
与等物质的量的![]() 发生加成反应
发生加成反应
B.2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热发生消去HCl的反应
C.甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G的结构简式为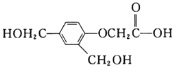 ,下列关于有机物G的说法错误的是
,下列关于有机物G的说法错误的是
A.分子式为C10H12O5
B.1 mol G与足量的金属钠反应,生成H2的体积为33.6 L
C.在一定条件下,1 mol G与足量的H2反应,最多消耗3 mol H2
D.可发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,欲实现下列有机物之间的转化,所选试剂正确的是( )
选项 | 物质转化 | 试剂 |
A |
| 足量酸性 |
B |
|
|
C |
| 浓硫酸和浓硝酸的混合溶液 |
D |
| 溴的四氯化碳溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“清肺排毒汤”来源于中医经典方剂组合,对新冠肺炎病毒感染的轻型、普通型的治疗具有良好的效果。其中的一味中药黄芩,其有效成分黄芩苷的结构简式如下图所示,下列有关黄芩苷的说法中正确的是( )
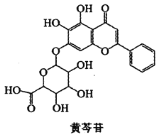
A.属于芳香族化合物,分子式为![]()
B.分子中苯环上的一氯代物有4种
C.可发生取代反应、加成反应,不能发生氧化反应
D.与足量![]() 发生加成反应后,官能团种类减少1种
发生加成反应后,官能团种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.电解CuCl2溶液:CuCl2=Cu2++2Cl-
B.Mg和Cl形成离子键的过程:![]()
C.向Al2(SO4)3溶液中滴加Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓
D.乙酸与乙醇发生酯化反应:CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯化氢为原料通过直接氧化法可以制取氯气,反应方程式为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) 。
(1)该法可按下列催化过程进行:
CuCl2(s)CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)CuO(s)+
O2(g)CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
①总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH=____kJ·mol-1。
②有利于提高总反应平衡产率的条件有______。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)恒温恒压下,可以说明总反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)达到平衡的是_________。
A.压强不变
B.氯气的体积分数保持不变
C.每生成2个H—O的同时,有4个H—Cl生成
D.反应速率v正(O2)∶v逆(H2O)=1∶2
E.各组分的物质的量浓度都相等

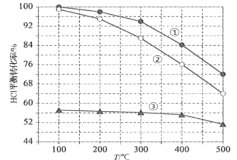
(3)密闭容器中充入HCl和O2进行反应,c(HCl)随时间t的变化曲线如图1,保持其他条件不变,t2时升温,t3时重新达平衡,画出t2—t4时c(Cl2)随时间t的变化曲线____。
(4)在刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时,HCl平衡转化率随温度变化的关系如图2:
①其中曲线①代表的c(HCl) ∶c(O2)是__________,原因__________。
②设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=4∶1的数据计算K(400℃)=__________(列出计算式,不必算出结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com