
【题目】某溶液中可能含有K+、NH4+、Ba2+、SO42-、I-、Cl-、NO3-中的几种,将此溶液分成两等份。进行如下实验:(AgCl式量为143.5,AgI式量为235)
①在一份溶液中加入足量NaOH,加热,可收集到标准状态下的气体1.12L;
②在另一份溶液中加入足量Ba(NO3)2溶液,有白色沉淀产生,过滤得到沉淀2.33g;
③在②的滤液中加入足量AgNO3溶液,又有4.7g沉淀产生。
有关该溶液中离子种类(不考虑H+和OH-)的判断正确的是
A.溶液中至少有2种阳离子
B.只能确定溶液中NH4+、SO42-是否存在
C.溶液中最多有4种阴离子
D.溶液中不可能同时存在K+和NO3-
【答案】C
【解析】
①在一份溶液中加入足量NaOH,加热,可收集到标准状态下的气体1.12L,和过量NaOH溶液加热产生的气体只能是氨气,故一定存在![]() ,且物质的量为0.05mol;
,且物质的量为0.05mol;
②在另一份溶液中加入足量Ba(NO3)2溶液,有白色沉淀产生,过滤得到沉淀2.33g,故一定存在![]() ,一定不含有Ba2+,且
,一定不含有Ba2+,且![]() 物质的量为:
物质的量为:![]() =0.01mol;
=0.01mol;
③在②的滤液中加入足量AgNO3溶液,又有4.7g沉淀产生,此沉淀未说明颜色,若沉淀只有AgCl,则![]() ,若沉淀只有AgI,则
,若沉淀只有AgI,则![]() ,若溶液中不含有K+、
,若溶液中不含有K+、![]() ,根据电荷守恒可知,I与Cl均存在,若溶液中不含有K+,含有
,根据电荷守恒可知,I与Cl均存在,若溶液中不含有K+,含有![]() 时,I与Cl可能均存在,也可能只I-,若溶液中含有K+,不含有
时,I与Cl可能均存在,也可能只I-,若溶液中含有K+,不含有![]() 时,I与Cl可能均存在,也可能只Cl-,不可能只含有I-。
时,I与Cl可能均存在,也可能只Cl-,不可能只含有I-。
A.依据分析可知,溶液中可能只存在铵根离子,故A错误;
B.依据分析可知,溶液中一定存在![]() 、
、![]() ,还有Cl或I中的一种或2种,故B错误;
,还有Cl或I中的一种或2种,故B错误;
C.依据分析可知,溶液中![]() 一定存在,而Cl或I存在1种或2种,
一定存在,而Cl或I存在1种或2种,![]() 也可能存在,故C正确;
也可能存在,故C正确;
D.由上述分析可知,溶液中可能同时存在K+和![]() ,故D错误;
,故D错误;
故答案为:C。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应式为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
A. 放电时负极的反应为:Zn-2e-+2OH-![]() Zn(OH)2
Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-![]() FeO42-+4H2O
FeO42-+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D. 放电时正极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)如图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
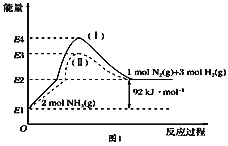
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为___________________.
②过程(Ⅰ)和过程(Ⅱ)的反应热________(填“相同”或“不同”).
③某温度下,在1 L恒温恒容容器中充入1molN2和3 mol H2进行上述反应,10 min达到平衡,此时容器内压强变为原来的7/8.
a.该过程的平衡常数的表达式为____________.
b.N2的平衡转化率为________.
c.此时若保持容器温度和体积不变,向其中再加入2.25 molN2和0.5 mol NH3,则平衡________(填“正向”“逆向”或“不”)移动.
(2)用NH3可以消除氮氧化物的污染,已知:
反应Ⅰ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
2N2(g)+6H2O(g) ΔH1=a kJ·mol-1 平衡常数为K1
反应Ⅱ:N2(g)+O2(g)![]() 2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
2NO(g) ΔH2=b kJ·mol-1 平衡常数为K2
反应Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
5N2(g)+6H2O(g) ΔH3=c kJ·mol-1 平衡常数为K3
则反应Ⅱ中的b=_____(用含a、c的代数式表示),K3=_____(用K1和K2表示).反应Ⅲ中的ΔS______(填“>”“<”或“=”)0.
(3)在恒容的密闭器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图所示:
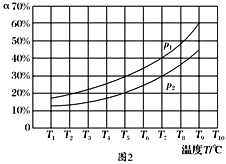
①分析得p1________p2.(填“>”“<”或“=”)
②下列叙述中,不能作为判断反应Ⅲ已经达到平衡状态的标志的是________(填序号).
a.N2的浓度不再改变 b.断裂6 mol N—H键的同时,有6 mol H—O键形成
c.容器中压强不再变化 d.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
Fe3O4(s)+4H2(g)达到平衡,保持温度不变,加入少量水蒸气,体系重新达到平衡,下列说法正确的是
A.水蒸气的体积分数增大B.氢气的浓度增大
C.平衡常数变大D.铁的质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
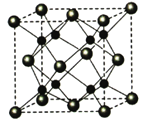
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为____________________,有___________个未成对电子。
(2)磷的一种同素异形体一一白磷(P4)的立体构型为_______________,其键角为___________,推测其在CS2中的溶解度___________(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因_________________________________。
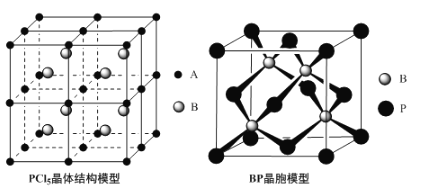
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如上左图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为___________,其中心原子杂化轨道类型为___________,B为___________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,上图为其立方晶胞,其中的每个原子均测是8电子稳定结构,试判断其熔点___________(填“高于”或“低于”)金刚石熔点。已知其B—P键长均为xcm,则其密度为___________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲烷的电子式为_____,其空间结构为_____;乙烯的结构简式为_____,乙烯通入溴水中的化学方程式为_____,其反应类型为_____,C5H12的烃有_____种同分异构体
(2)一装有等体积氯气和甲烷的量筒倒扣在盛水的水槽中,放在室外一段时间后,可观察到的现象是量筒内气体颜色变浅、_____、_____、量筒内液面上升,写出该反应生成一氯甲烷的化学方程式_____,该反应类型为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.苯的同系物是分子中仅含有一个苯环的所有烃类物质
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1923年,我国化学家吴蕴初先生研制出了廉价生产味精的方案,并向英、美、法等化学工业发达国家申请了专利。以下是利用化学方法合成味精的流程:
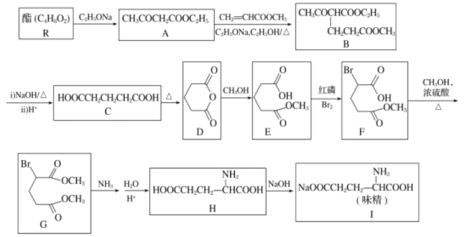
请回答下列问题:
(1)下列有关蛋白质和氨基酸的说法不正确的是____(填字母)。
a.蛋白质都是高分子化合物
b.谷氨酸(H)自身不能发生反应
c.H分子不含手性碳原子
d.天然蛋白质水解最终产物都是α-氨基酸
(2)C的系统命名法名称是____;B中含氧官能团名称是____。
(3)E→F的反应类型是____。R的结构简式为____。
(4)写出G和NH3反应的化学方程式:____。
(5)T是H的同分异构体,写出同时具备下列条件的T的结构简式______________。
①含有—NH2,且能发生水解反应;
②1molT发生银镜反应能生成4molAg
③核磁共振氢谱上有4组峰且峰面积比为2∶2∶2∶3
(6)参照题给流程图,以![]() 和甲醇为原料(其他无机试剂任选),设计合成苯丙氨酸(
和甲醇为原料(其他无机试剂任选),设计合成苯丙氨酸(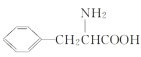 )的流程,写出合成路线____。
)的流程,写出合成路线____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com