【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制城法”生产纯碱和化肥NH4Cl.工艺流程如图所示。下列有关说法不正确的是

A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 粗盐可采用除杂和重结晶等过程提纯
C. 流程图中的系列操作中用到的玻璃仪器可能有玻璃棒、烧杯、漏斗、坩埚等
D. 该流程中得到的晶体用到了溶解度的差异性
参考答案:
【答案】A
【解析】A、除去粗盐中的Ca2+、Mg2+、SO42-等离子,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠除去钙离子和过量的钡离子,盐酸要放在最后,用来除去过量的氢氧化钠和碳酸钠,A错误;B、根据A中分析可知粗盐可采用除杂和重结晶等过程提纯,B正确;C、溶解、过滤需要烧杯、玻璃棒和漏斗,碳酸氢钠分解需要坩埚,C正确;D、碳酸氢钠的溶解度较小,因此向饱和的氯化钠溶液中分别通入氨气、CO2后会产生碳酸氢钠晶体,用到了溶解度的差异性,D正确,答案选A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据如图所示装置(部分仪器已略去)回答下列有关问题。
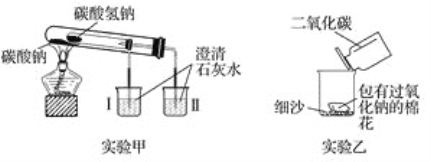
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的化学方程式是____________________________________,通过实验甲可证明_____________(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来探究Na2O2与CO2的反应,观察到的实验现象为包有Na2O2的棉花着火。写出Na2O2与CO2反应的化学方程式:______________________________,棉花着火说明该反应的特点是____________________________。
(3)取10 g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石水中,测得生成沉淀的质量为4.0 g。则原混合物中碳酸钠的质量分数为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】只给出下列甲和乙中对应的量,不能组成一个求物质的量的公式的是( )
①
②
③
④
⑤
甲
物质粒子数
标准状况下气体摩尔体积
固体体积
物质的质量分数
非标准状况下
物质的质量
乙
阿伏加德罗常数
标准状况下气体体积
固体密度
溶液的体积
物质的摩尔质量
A. ②⑤ B. ①②
C. ③④ D. ①⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列情况下的反应一定能自发进行的是( )
A.△H>0△S<0
B.△H>0△S>0
C.△H<0△S<0
D.△H<0△S>0 -
科目: 来源: 题型:
查看答案和解析>>【题目】在同温同压下,一定量的某有机物和过量的金属钠反应产生a L氢气,另取等量的该有机物与足量的小苏打溶液反应,可以收集二氧化碳气体b L,若a=b,则该有机物可能是( )
A.HOOC﹣COOH
B.HOOC﹣CH2CH2OH
C.HOCH2﹣CH2OH
D.CH3COOH -
科目: 来源: 题型:
查看答案和解析>>【题目】某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为( )
A.1∶2B.1∶4C.3∶4D.3∶2
-
科目: 来源: 题型:
查看答案和解析>>【题目】用下列仪器的编号回答问题
①容量瓶 ②蒸馏烧瓶 ③温度计 ④量筒 ⑤烧杯 ⑥托盘天平 ⑦分液漏斗
(1)加热时必须垫石棉网的有_______________,
(2)使用时必须检查是否漏水的有_______________,
(3)标有零刻度的有_______________。
相关试题

