
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
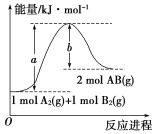
(1)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示请写出该反应的热化学方程式____。
(2)实验测得,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧的热化学方程式:_______。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为_________。
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
【答案】A2(g)+B2(g)===2AB(g) ΔH=(a-b) kJ·mol-1 C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-1366.2 kJ·mol-1 -488.3 kJ·mol-1
【解析】
(1)依据△H=反应物的活化能-生成物活化能求算;
(2)1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,算出1mol乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7×46 kJ=1366.2 kJ的热量,写出热化学方程式;
(3)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
结合盖斯定律可知,②×2+③×2-①得到2C(s)+2H2(g)+O2(g)═CH3COOH(l),以此来解答。
(1)由图依据△H=反应物活化能-生成物活化能=(a-b)kJ·mol-1 ,反应的热化学方程式:A2(g)+B2(g)=2AB(g) ΔH=(a-b) kJ·mol-1;
(2)1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,算出1mol乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7×46 kJ=1366.2 kJ的热量,写出热化学方程式:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1366.2 kJ·mol-1 ;
(3)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
结合盖斯定律可知,②×2+③×2-①得到2C(s)+2H2(g)+O2(g)═CH3COOH(l),其△H=(-393.5kJ·mol-1)×2+(-285.8kJ·mol-1)×2-(-870.3kJ·mol-1)=-488.3kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)==CO2(g)+2H2O(g)△H=-890.3kJ/mol
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ/mol
2NH3(g)△H=-38.6kJ/mol
C.NaOH(s)+1/2 H2SO4(浓)==1/2Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
D.2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)△H=-2589.6kJ/moL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mL NaOH溶液中投入10.8g Al,二者恰好完全反应,计算:
(1)Al的物质的量__________。
(2)参加反应的NaOH的物质的量__________和NaOH溶液的物质的量浓度___________。
(3)生成的H2在标准状况下的体积____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )

A. a管发生吸氧腐蚀,b管发生析氢腐蚀
B. 一段时间后,a管液面高于b管液面
C. a处溶液的pH增大,b处溶液的pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯消毒剂有多种,二氧化氯可用于自来水消毒,84消毒液用于家庭、宾馆的消毒。
I.实验室可用亚氯酸钠固体与应制备ClO2:2NaClO2+Cl2=2ClO2+2NaCl,装置如图所示:
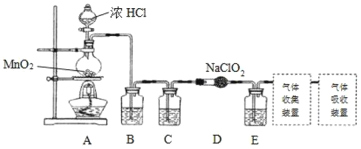
(1)装置A中,盛装浓盐酸的仪器名称为___,开始反应后,圆底烧瓶内发生的反应的离子反应方程式为:__。
(2)已知常温常压下,ClO2和Cl2是气体,在不同溶剂中溶解性如表所示:B、C、E装置中的试剂依次是___(填编号)
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 易溶 |
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.CCl4
(3)使用ClO2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。Fe2+消除ClO2-的离子方程式为__。
II.某同学在家中自制出与“84消毒液”成分(NaClO和水)相同的消毒液。主要器材有6V变压器、两支木杆铅笔、废纯净水瓶、食盐、卫生纸、绝缘胶布、小刀等。
(4)实验过程:向一个废弃的纯净水瓶中灌入大半瓶自来水,并加入3调味匙食盐,用卫生纸将用铅笔做成的电极包好,并插入纯净水瓶中,使电极恰好卡在瓶口,装置如图,接通电源后,可以看到一侧电极无明显现象,另一侧电极有细小的气泡产生,请写出该电极反应式为:___;持续通电约3小时后,发现原先无明显现象的电极附近也开始产生一定量的细小气泡,此电极此时的电极反应式___。看到该现象后停止通电。

(5)用该方法制备消毒液的总化学方程式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)![]() 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( )
①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.
A. ⑤⑥⑧B. ②⑤⑧C. ①③④D. ②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g) ===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B. 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g) ===2CO(g) ΔH=-110.5 kJ·mol-1
C. 已知:H2(g)+ ![]() O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
D. 已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据世界权威刊物《自然》最近报道, 选择碲化锆 (ZrTe5)为材料验证了三维量子霍尔效应, 并发现了金属-绝缘体的转换。Te属于ⅥA元素。回答下列问题:
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是___,Zr2+的价电子排布图是___。
(2)O、Se、Te的第一电离能由大到小的顺序是___,H2O、H2Se、H2Te的沸点由高到低的顺序是___。
(3)H2Te和CO2 均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是___。
(4) [Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___(填符号), 1个[Zr(C2H5O)2]2+离子中含共价键的数目是___。
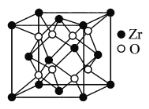
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是___。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为___ g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com