【题目】下列有关实验操作、实验现象和所得结论均正确的是
实验操作 | 实验现象 | 结论 | |
A | 在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液 | 产生大量气泡 | Fe3+能催化H2O2的分解 |
B | 用0.100molL-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) | 溶液由橙色变红色,且在半分钟内不恢复 | 滴定到达终点 |
C | 向浓度均为0.1 mol·L-1NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
D | 往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液 | 产生白色沉淀,红色褪去 | 证明CO32-水解呈碱性 |
A. A B. B C. C D. D
【答案】D
【解析】A.氯化铁溶液中含有铁离子和氯离子,在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液,产生大量气泡,可能是氯离子的作用,不能证明Fe3+能催化H2O2的分解,故A 错误;B.用0.100molL-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) ,达到终点时生成物为氯化钠,溶液显中性,若溶液由橙色变红色,且在半分钟内不恢复,说明溶液显酸性,消耗标准液体积偏大,依据c(待测)= 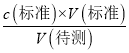 可知,NaOH溶液浓度偏大,故B错误;C.滴加少量AgNO3溶液,产生黄色沉淀,可知Ksp小的先沉淀,则Ksp(AgCl)>Ksp(AgI),故C错误;D.Na2CO3溶液水解显碱性,遇酚酞变红,加CaCl2溶液,水解平衡逆向移动,则证明Na2CO3溶液中存在水解平衡,故D正确;故选D。
可知,NaOH溶液浓度偏大,故B错误;C.滴加少量AgNO3溶液,产生黄色沉淀,可知Ksp小的先沉淀,则Ksp(AgCl)>Ksp(AgI),故C错误;D.Na2CO3溶液水解显碱性,遇酚酞变红,加CaCl2溶液,水解平衡逆向移动,则证明Na2CO3溶液中存在水解平衡,故D正确;故选D。

