【题目】不同温度下,三个体积均为1 L的密闭容器中发生反应3H2(g)+N2(g)![]() 2NH3(g)ΔH =-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表。下列说法正确的是
2NH3(g)ΔH =-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表。下列说法正确的是
容器编号 | 温度(K) | 起始物质的量/mol | 平衡物质的量/mol | ||
H2 | N2 | NH3 | H2 | ||
Ⅰ | T1 | 3 | 1 | 0 | 2.4 |
Ⅱ | T2 | 1.2 | 0.4 | 0.2 | 1.2 |
Ⅲ | T1 | 2 | 0.2 | 0.2 | |
A. T1>T2
B. 平衡时,容器Ⅰ中反应放出的热量为92.6 kJ
C. 容器Ⅰ和容器Ⅱ中反应的化学平衡常数相同
D. 容器Ⅲ中的反应起始时向逆反应方向进行
参考答案:
【答案】AD
【解析】
根据平衡移动原理、浓度商与K的关系、热化学方程式的含义分析解答。
A项:容器II相当于起始投料1.5molH2、0.5molN2,恰好为容器I中H2、N2量的一半。若容器II的体积为0.5L,则T1温度下容器I、II中化学平衡等效,容器II中H2量应为容器I的一半,即1.2mol。现容器II体积为1L、温度为T2,平衡时H2量为1.2mol,即体积从0.5L增大到1L、温度从T1改变到T2,容器II中的平衡没有移动。因为减压(增大体积)使平衡逆向移动、该反应为放热反应,所以只有降温(T1>T2)使平衡正向移动,才能抵消减压的影响,使容器II中化学平衡不移动。A项正确;
B项:热化学方程式中的ΔH为反应进行完全时的数据。因为反应可逆,容器I中3molH2、1molN2不可能完全反应,故平衡时放热少于92.6 kJ。B项错误;
C项:化学平衡常数与温度有关。容器Ⅰ和容器Ⅱ的温度不同,化学平衡常数也不同。C项错误;
D项:容器I、Ⅲ温度相同,平衡常数相同。容器I中平衡时有2.4mol·L-1H2、0.8mol·L-1N2、0.2mol·L-1NH3,求得平衡常数K=0.0145。容器III起始时Qc=0.025>K,故起始时反应向逆反应方向进行。D项正确。
本题选AD。
-
科目: 来源: 题型:
查看答案和解析>>【题目】20℃时,配制一组c(H2A)+ c(HA-)+ c(A2-)=0.100 mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法正确的是

A. H2A在水中的电离方程式为:H2A=HA-+ H+,HA-
 H++A2-
H++A2-B. c(Na+)=0.100 mol·L-1的溶液中,c(H+)+c(H2A)=c(OH-)+ c(A2-)
C. pH=4的溶液中,c(HA-)>c(H2A)+ c(A2-)
D. pH=7的溶液中,c(Na+)=2c(A2-)
-
科目: 来源: 题型:
查看答案和解析>>【题目】有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧环己烯。其中既不能使酸性KMnO4溶液褪色,也不能使溴的CCl4溶液褪色的是( )
A.①②③⑤B.④⑥⑦⑧C.①④⑥⑦D.②③⑤⑧
-
科目: 来源: 题型:
查看答案和解析>>【题目】标准状况下,某气态烷烃和烯烃(含一个双键)的混合气体2.24 L完全燃烧后,将产生的气体缓慢通过浓硫酸,浓硫酸增重4.05 g,剩余气体通过碱石灰,碱石灰增重6.60 g。另再取2.24 L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05 g。
(1)确定混合气体由哪两种烃组成_______。
(2)计算混合气体中两种烃的体积分数_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在试管A中先加入3 mL无水乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸,最后加入2 mL冰醋酸,按下图装置进行实验,并将产生的蒸气经导管通到试管B中饱和碳酸钠溶液的液面上。请回答下列问题:

(1)浓硫酸的作用是__________________________________________。
(2)试管B中观察到的现象是_____________________________。
(3)若试管B中的饱和碳酸钠溶液用冷水代替,实验结束后不能闻到香味的可能原因是________________________________________________________________________。
(4)试管B中的饱和碳酸钠溶液的作用是__________________________________。
(5)通入蒸气的导管不能插入试管B中液面下的原因是_______________________________________。
(6)通入蒸气常选用长导管的目的是________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)==
 CH3OCH3(g)+
CH3OCH3(g)+ 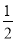 H2O(1)的ΔH =
H2O(1)的ΔH = kJmol-1
kJmol-1D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定条件下,向2L密闭容器中加入2molX、1molY。发生如下反应:2X(g)+Y(?)
 3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
相关试题

