【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
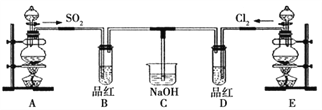
(1)实验室用装置A制备SO2。从物质类别看,SO2属于________(填“酸性”、“两性”或“碱性”)氧化物;
(2)实验室用装置E制备Cl2,写出该反应的离子方程式:___________________________。当有0.2 mol电子转移时,产生氯气的体积(标准状况)是________,氧化剂与还原剂的物质的量之比是________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________________,D:________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1︰1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________________________。
(5)有人预测SO2能使酸性高锰酸钾溶液褪色,你认为该预测是否合理?________(填“合理”或“不合理”),理由是________________________________________________。
参考答案:
【答案】 酸性 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 2.24 L 1∶2 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O=2HCl+H2SO4 合理 SO2具有还原性,KMnO4具有强氧化性,SO2可将KMnO4还原,溶液变为无色
Mn2++Cl2↑+2H2O 2.24 L 1∶2 褪色的品红又恢复成红色 无明显现象 Cl2+SO2+2H2O=2HCl+H2SO4 合理 SO2具有还原性,KMnO4具有强氧化性,SO2可将KMnO4还原,溶液变为无色
【解析】分析:(1)根据二氧化硫的性质分析分析;
(2)实验室利用浓盐酸与二氧化锰加热制备氯气;根据氧化还原反应的有关概念和电子得失守恒计算;
(3)根据二氧化硫的漂白不稳定,氯气溶于水生成的次氯酸具有强氧化性,其漂白是不可逆的解答;
(4)根据氯气能氧化二氧化硫分析;
(5)根据二氧化硫具有还原性分析。
详解:(1)二氧化硫能与碱反应生成盐和水,因此二氧化硫是酸性氧化物;
(2)实验室用装置E制备Cl2,反应需要加热,说明反应物是二氧化锰和浓盐酸,该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。反应中氯元素化合价从-1价升高到0价,失去1个电子,即得到1mol氯气转移2mol电子,所以当有0.2 mol电子转移时,产生氯气的体积(标准状况)是0.1mol×22.4L/mol=2.24L;二氧化锰是氧化剂,氯化氢是还原剂,4mol氯化氢参加反应有2mol是还原剂,则氧化剂与还原剂的物质的量之比是1∶2。
Mn2++Cl2↑+2H2O。反应中氯元素化合价从-1价升高到0价,失去1个电子,即得到1mol氯气转移2mol电子,所以当有0.2 mol电子转移时,产生氯气的体积(标准状况)是0.1mol×22.4L/mol=2.24L;二氧化锰是氧化剂,氯化氢是还原剂,4mol氯化氢参加反应有2mol是还原剂,则氧化剂与还原剂的物质的量之比是1∶2。
(3)二氧化硫的漂白是与有色物质化合生成不稳定的无色物质,漂白是不稳定的,氯气溶于水生成的次氯酸具有强氧化性,其漂白是不可逆的,因此停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B中褪色的品红又恢复成红色,D中无明显现象。
(4)氯气具有强氧化性,能把二氧化硫氧化为硫酸,从而失去漂白性,所以将制得的SO2和Cl2按1︰1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样,反应的化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4。
(5)由于SO2具有还原性,KMnO4具有强氧化性,SO2可将KMnO4还原,溶液变为无色,因此SO2能使酸性高锰酸钾溶液褪色。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在含有大量K+、OH﹣、CO32﹣的溶液中还可能大量存在的离子是( )
A.NH4+
B.Al3+
C.Ca2+
D.SO42﹣ -
科目: 来源: 题型:
查看答案和解析>>【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
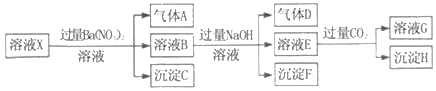
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的转化在给定条件下能实现的是( )
①NaAlO2(aq)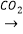 Al(OH)3
Al(OH)3 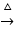 Al2O3(熔融)
Al2O3(熔融)  Al
Al 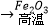 Fe
Fe
②S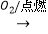 SO3
SO3 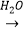 H2SO4
H2SO4
③Cu(OH)2CO3 CuCl2(aq)
CuCl2(aq)  Cu
Cu
④Fe2O3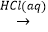 FeCl3
FeCl3 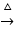 无水FeCl3
无水FeCl3
⑤饱和NaCl(aq)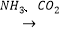 NaHCO3
NaHCO3 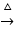 Na2CO3 .
Na2CO3 .
A.①③⑤
B.②③④
C.②④⑤
D.①④⑤ -
科目: 来源: 题型:
查看答案和解析>>【题目】将纯锌片和纯铜片插入同浓度的稀硫酸中一段时间,下列叙述正确的是
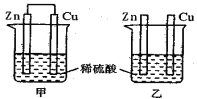
A. 甲中铜片是正极,乙中铜片是负极
B. 甲中铜被氧化,乙中锌被氧化
C. 产生气泡的速率甲比乙快
D. 两烧杯中铜片表面均无气泡产生
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④
C. ①④⑤ D. ①②③④⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】298 K时,在2 L固定体积的密闭容器中,发生可逆反应:2NO2(g)
 N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )
N2O4(g) ΔH=-a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,若反应在398 K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时,下列大小关系正确的是( )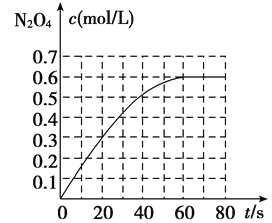
A. v(正)>v(逆)
B. v(正)<v(逆)
C. v(正)=v(逆)
D. v(正)、v(逆)大小关系不确定
相关试题

