【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:
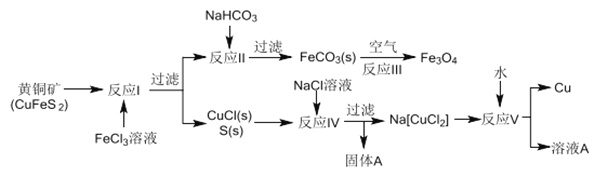
(1)黄铜矿中Cu 的化合价是______,反应I中65gFeC13 可氧化________mol CuFeS2。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有______。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3mol/L)可产生FeCO3沉淀时的最小Fe2+浓度是_________(己知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________。
(5)固体物质A的成分________(写名称)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红,写出相关的化学方程式:_______________。
(7)本流程中可实现循环使用的物质除了水外,还有_____________
参考答案:
【答案】 +2 0.1 AB 2.5×10-8mol/L 6FeCO3+O2![]() 2Fe3O4+6CO2 硫 6FeCO3+O2+6H2O==4Fe(OH)3+4CO2 氯化钠
2Fe3O4+6CO2 硫 6FeCO3+O2+6H2O==4Fe(OH)3+4CO2 氯化钠
【解析】 (1)根据化合价的代数和为0,黄铜矿CuFeS2中Cu 的化合价为+2价,Fe为+2价,S为-2价;65gFeC13 的物质的量为![]() =0.4mol,反应后得到0.4mol电子,根据流程图,反应后生成CuCl和S,只有S元素被氧化,根据得失电子守恒,能够氧化0.1mol CuFeS2,故答案为:+2;0.1;
=0.4mol,反应后得到0.4mol电子,根据流程图,反应后生成CuCl和S,只有S元素被氧化,根据得失电子守恒,能够氧化0.1mol CuFeS2,故答案为:+2;0.1;
(2) 沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离,沉淀呈胶状或絮状,静止后不容易沉降,不能采取倾析法分离,故选AB;
(3)在反应Ⅱ中, NaHCO3饱和溶液中CO32-平衡浓度为1.2×10-3mol/L,可产生FeCO3沉淀时的最小Fe2+浓度为 =
=![]() =2.5×10-8mol/L,故答案为:2.5×10-8mol/L;
=2.5×10-8mol/L,故答案为:2.5×10-8mol/L;
(4)反应Ⅲ中,在设备底部鼓入空气,碳酸亚铁被氧化生成磁性氧化铁(Fe3O4),反应的化学方程式为6FeCO3+O2![]() 2Fe3O4+6CO2,故答案为:6FeCO3+O2
2Fe3O4+6CO2,故答案为:6FeCO3+O2![]() 2Fe3O4+6CO2;
2Fe3O4+6CO2;
(5)根据流程图,加入氯化钠溶液将CuCl转化为络合物,固体物质A为硫,故答案为:硫;
(6)亚铁离子具有还原性,在潮湿的空气中FeCO3固体被氧化变红,反应的化学方程式6FeCO3+O2+6H2O==4Fe(OH)3+4CO2,故答案为:6FeCO3+O2+6H2O==4Fe(OH)3+4CO2;
(7)根据流程图,溶液A中含有氯化钠,可以参与循环使用,故答案为:氯化钠。
-
科目: 来源: 题型:
查看答案和解析>>【题目】据研究,若把太阳光变成激光用于分解海水制氢,反应可表示为:
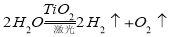 。有下列几种说法:① 水分解反应是放热反应;② 氢气是可再生能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是( )
。有下列几种说法:① 水分解反应是放热反应;② 氢气是可再生能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是( ) A.①② B.③④ C.②③④ D.①②③④
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应中,属于氧化还原反应的是
A. 2NaHCO3
 Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2OB. H2SO4 + CuO === CuSO4 + H2O
C. 2H2S + SO2 === 3S↓ + 2H2O
D. CO2 + Ca(OH)2 === CaCO3↓+ H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
实验后的记录:

①Zn为正极,Cu为负极
②Cu极上有气泡产生,发生还原反应
③SO42﹣向Zn极移动
④若有0.5mol电子流经导线,则产生5.6L气体
⑤电流的流向是:Cu→Zn
⑥负极反应式:Cu﹣2e﹣═Cu2+,发生氧化反应.
A.②④⑤ B.②③⑤ C.①④⑥ D.③④⑤⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1.0mol Cr3+反应所需PbO2的物质的量为( )
A. 3.0mol B. 2.5mol C. 1.5mol D. 0.75mol
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各组离子一定能大量共存的是( )
A. 在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B. 在含大量Ba2+溶液中:NH4+、Na+、Cl-、OH-
C. 在强碱溶液中:Na+、K+、Cl-、SO32-
D. 在强酸性溶液中:K+、Fe2+、Cl-、CH3COO-
相关试题

