【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素。Y的单质经常作为保护气;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断正确的是
A. Y的最简单氢化物的热稳定性比Z的强
B. 在同周期元素中,W的最高价氧化物对应的水化物的酸性最强
C. 离子半径:X<Y<Z<W
D. 含W的盐溶液可能呈碱性
参考答案:
【答案】D
【解析】Y的单质经常作为保护气,Y为N元素;由Z、W形成的一种化合物可与X、W形成的化合物反应生成淡黄色固体,此反应为SO2+2H2S=3S+2H2O,X、Y、Z、W的原子序数依次增大,X为H元素,Z为O元素,W为S元素。A,非金属性:Y(N)![]() Z(O),最简单氢化物的热稳定性:NH3
Z(O),最简单氢化物的热稳定性:NH3![]() H2O,A项错误;B,W为S,S处于第三周期,第三周期元素中最高价氧化物对应水化物酸性最强的是HClO4,B项错误;C,根据“层多径大,序大径小”,离子半径:X
H2O,A项错误;B,W为S,S处于第三周期,第三周期元素中最高价氧化物对应水化物酸性最强的是HClO4,B项错误;C,根据“层多径大,序大径小”,离子半径:X![]() Z
Z![]() Y
Y![]() W,C项错误;D,含S的盐溶液如Na2S、Na2SO3等溶液呈碱性,Na2SO4等溶液呈中性,NaHSO3溶液等呈酸性,D项正确;答案选D。
W,C项错误;D,含S的盐溶液如Na2S、Na2SO3等溶液呈碱性,Na2SO4等溶液呈中性,NaHSO3溶液等呈酸性,D项正确;答案选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 硅晶体中,有NA个Si就有2 NA个Si—Si键
B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
C. 惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L
D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】有下图所示装置:
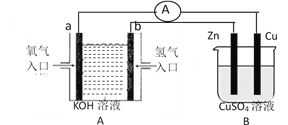
(1)装置A中b的电极名称为________极,a电极反应式为___________________________________;
(2)B装置中Cu为________极,电极反应式为___________________________________;
(3)当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为______________ L。
-
科目: 来源: 题型:
查看答案和解析>>【题目】滴定实验是化学学科中重要的定量实验。
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250 mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号
待测液体积(mL)
所消耗标准盐酸的体积(mL)
滴定前
滴定后
1
25.00
0.50
20.60
2
25.00
6.00
26.00
3
25.00
1.10
21.00
请回答下列问题:
(1)滴定终点时的现象是_______________________________________。
(2)所配制的250 mL样品液中NaOH的物质的量浓度是_________ mol·L-1;试样中NaOH的质量分数为__________________。
(3)若出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
-
科目: 来源: 题型:
查看答案和解析>>【题目】判断AB2型分子是极性分子的主要依据是( )
A. 分子中存在离子键 B. 分子中存在极性键
C. 分子为直线形 D. 分子为非直线形
-
科目: 来源: 题型:
查看答案和解析>>【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)
 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于胶体应用与其性质的对应不正确的是( )
A.鉴别胶体与浊液(丁达尔效应)
B.高压除尘(电泳现象)
C.河海交汇处可沉积沙洲(聚沉)
D.喷雾剂的应用(布朗运动)
相关试题

