【题目】已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 molL﹣1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )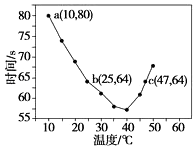
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中a点对应的NaHSO3反应速率为5.0×10﹣5 molL﹣1s﹣1
C.图中b、c两点对应的NaHSO3反应速率相等
D.40℃之后,淀粉不宜用作该实验的指示剂
参考答案:
【答案】C
【解析】A.从图象中可以看出,40℃以前,温度越高,反应速度越快,40℃后温度越高,变色时间越长,反应越慢,而55℃,未变蓝,说明没有生成I2,A不符合题意;
B.a点时间为80s,浓度变化量为 ![]() =0.004mol/L,a点对应的NaHSO3反应速率为5.0×10﹣5molL﹣1s﹣1,B不符合题意;
=0.004mol/L,a点对应的NaHSO3反应速率为5.0×10﹣5molL﹣1s﹣1,B不符合题意;
C.b点的反应原理为:当碘酸钾过量时,生成碘单质,其离子反应式为5SO32﹣+2IO3﹣+2H+=5SO42﹣+I2+H2O,而图中c点的反应原理为2IO3﹣+5SO2+4H2O=5SO42﹣+I2+8H+,则图中b、c点对应的反应原理不一样,且温度不同,故反应速率不同,C符合题意;
D.55℃时,没有出现蓝色,故淀粉已不能作为该反应的指示剂,D不符合题意;
故答案为:C
A.结合图像中曲线的变化趋势分析即可;
B.先确定a点事浓度的变化量,再结合公式![]() 计算;
计算;
C.bc两点反应原理不同,无法比较反应速率;
D.根据题“55℃时未观察到溶液变蓝”确定不能用淀粉做指示剂;
-
科目: 来源: 题型:
查看答案和解析>>【题目】HNO2是一种弱酸,且不稳定,易分解生成 NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成 Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有 Fe2+。若误食亚硝酸盐(如NaNO2 ),则导致血红蛋白中的 Fe2+转化为 Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是_________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将 Fe3+还原为 Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,能用来区分NaNO2和NaCl的是_____(填序号)。
A.分别溶于水看溶解情况
B.在酸性条件下加入KI—淀粉溶液来区别
C.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和 HCl,请写出反应的离子方程式:____________________________________。
(4)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是______(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为 2∶1,试配平下列方程式:________________
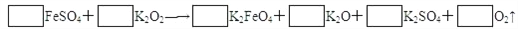 .
. -
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸的反应B.灼热的木炭与二氧化碳的反应
C.甲烷在空气中燃烧D.Ba(OH)2·8H2O 晶体与 NH4Cl 晶体的反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】可逆反应2A(g)+B(g)
 2C(g),根据下表中的数据判断下列图象错误的是( )
2C(g),根据下表中的数据判断下列图象错误的是( )
p1(Mpa)
p2(Mpa)
400℃
99.6
99.7
500℃
96.9
97.8
A.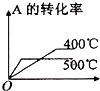
B.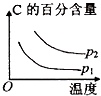
C.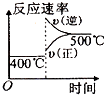
D.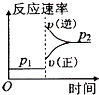
-
科目: 来源: 题型:
查看答案和解析>>【题目】无色的混合气体甲,可能含有 NO、 CO2、NO2、NH3、N2 中的某几种。将 100 mL 甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为( )

A. NH3、NO2、N2 B. NH3、NO2、CO2 C. NH3、NO、CO2 D. NO、CO2、N2
-
科目: 来源: 题型:
查看答案和解析>>【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定温度下将1molCO 和3mol 水蒸气放在密闭的容器中发生下列反应CO(g)+H2O(g)CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol 水蒸气,达到新的平衡后,CO2和H2的物质的量之和为( )
A.1.2 mol
B.1.5 mol
C.1.8 mol
D.2.1 mol
相关试题

