【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为_______,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为________________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(夹持装置未画出)。
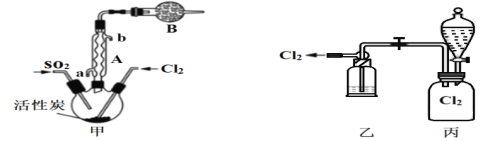
①仪器A的名称为___________,装置乙中装入的试剂_____________,装置B的作用是_______________________。
②装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 mol/L浓盐酸
C.浓氢氧化钠溶液 D.饱和食盐水
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。
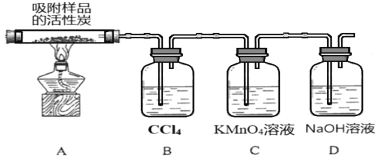
①加热时A中试管出现黄绿色,装置B的作用是 ____________。
②装置C中的现象是___________,反应的离子方程式为___________________。
【答案】+6 SO2Cl2+2H2O=2HCl↑+H2SO4 (球形)冷凝管 浓硫酸 防止空气中水蒸汽进入三颈烧瓶,使SO2Cl2发生水解变质;吸收尾气SO2和Cl2,防止污染环境。 D 吸收Cl2 C中KMnO4溶液褪色 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+
【解析】
(1)根据化合物中正负化合价的代数和为0判断S元素的化合价,SO2Cl2在潮湿空气中因水解“发烟”,生成的HCl溶于水,呈现白雾。;
(2)①根据图示仪器的结构特点可知仪器的名称,乙中浓硫酸可干燥氯气,装置B中碱石灰可吸收尾气;
②通过滴加液体,排除装置中的氯气,使氯气通过装置乙到装置甲中;
(3)①加热时A中试管出现黄绿色,装置B中四氯化碳可吸收生成的氯气;
②装置C中二氧化硫与高锰酸钾反应。
(1)SO2Cl2中S的化合价为0-(-1)×2-(-2)×2=+6,SO2Cl2在潮湿空气中因水解“发烟”,生成了HCl,其化学方程式为SO2Cl2+2H2O=2HCl↑+H2SO4;
(2)①仪器A的名称为(球形)冷凝管,装置乙中装入的试剂为浓硫酸,装置B的作用是防止空气中水蒸汽进入三颈烧瓶,使SO2Cl2发生水解变质,吸收尾气SO2和Cl2,防止污染环境;
②氯气不溶于饱和食盐水,通过滴加饱和食盐水,将氯气排出,其它均不符合,故合理选项是D;
(3)SO2Cl2分解生成了Cl2,根据化合价Cl的化合价升高,化合价降低只能是S元素,S从+6降低到+4,生成SO2。
①加热时A中试管出现黄绿色,说明生成了Cl2,装置B的作用是吸收Cl2;
②装置C中的现象是KMnO4溶液褪色,SO2与KMnO4反应,反应的离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。

