
【题目】SO2是大气污染物之一,也是重要的化工原料。
(1)某温度下,反应![]()
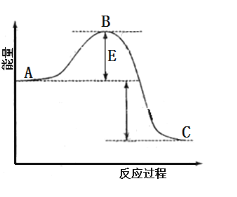
![]() 的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
的能量变化如图。根据反应自发性判断,反应在______(填“高温”“低温”或“任何温度”)条件下可能有自发性,逆反应的活化能为______。
(2)将0.1 mol O2和0.2 mol SO2通入一容积可变的容器中进行反应:![]() 。测得SO2的平衡转化率随温度、压强的变化如图。
。测得SO2的平衡转化率随温度、压强的变化如图。
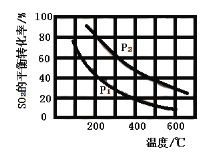
①![]() ______(填“>”“<”或“=”)
______(填“>”“<”或“=”)![]() 。
。
②若在300℃、压强为![]() 时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
时,反应达到平衡,容器容积恰好为10 L,则此状态下反应的平衡常数K=____________。
③反应![]() 在
在![]() 时刻达到平衡后,在
时刻达到平衡后,在![]() 时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
时刻速率发生如图所示变化,此刻可能改变的反应条件可能是______(填标号)。
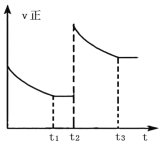
A.加压B.向体系中再通入一定量SO2
C.升高温度D.加催化剂
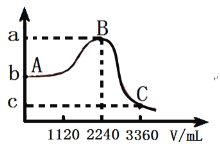
(3)常温下,向1L![]() 的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则
的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),该溶液的pH与通入SO2气体的体积(标准状况)的关系如图,则![]() _____;
_____;![]() _____;
_____;![]() _____。已知:常温下,氢硫酸的
_____。已知:常温下,氢硫酸的![]() 、
、![]() ,亚硫酸的
,亚硫酸的![]() 、
、![]() ;
;![]() 。
。
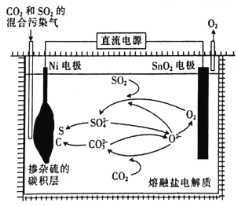
(4)用电解法处理CO2和SO2的混合污染气的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层,则与Ni电极相连的是电源的______(填“正极”或“负极”);阳极的电极反应式为________________________。
【答案】低温 ![]() <
< ![]() AB 7 3.8 1.6 负极
AB 7 3.8 1.6 负极 ![]()
【解析】
(1)根据反应的特点以及反应能自发进行的条件![]() 进行分析;反应热
进行分析;反应热![]() ;
;
(2)①根据压强对平衡移动的影响分析;
②列出三段式计算平衡常数;
③根据外界因素对反应速率和化学平衡的影响分析;
(3)结合化学反应以及弱酸的电离平衡常数进行计算;
(4)根据电解原理进行分析。
(1)反应![]() 为气体物质的量减小的反应,由该反应的能量变化图可知其
为气体物质的量减小的反应,由该反应的能量变化图可知其![]() 、
、![]() ,若反应能自发进行,则
,若反应能自发进行,则![]() ,故该反应在低温条件下可能有自发性;由图可知该反应的正反应的活化能为E,又
,故该反应在低温条件下可能有自发性;由图可知该反应的正反应的活化能为E,又![]() ,故逆反应的活化能
,故逆反应的活化能![]() ;
;
(2)①该反应的正反应为气体物质的量减小的反应,当温度一定时,加压平衡正向移动,SO2的平衡转化率增大,故![]() <
<![]() ;
;
②温度为300℃、压强为![]() 时,反应达到平衡,SO2的平衡转化率为60%,容器容积恰好为10 L,可列出三段式(单位为mol):
时,反应达到平衡,SO2的平衡转化率为60%,容器容积恰好为10 L,可列出三段式(单位为mol):
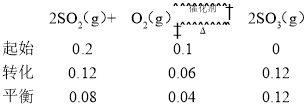 ,
,
此时c(SO2)=0.008mol/L,c(O2)=0.004mol/L,c(SO3)=0.012mol/L,则此状态下反应的平衡常数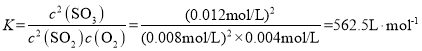 ;
;
③A. 加压瞬间,正、逆反应速率均增大,又平衡正向移动,则正反应速率大于逆反应速率,随反应进行,正反应速率逐渐减小,逆反应速率逐渐增大,故A符合;
B. 向体系中再通入一定量SO2,正反应速率瞬间增大,逆反应速率不变,随反应进行,正反应速率逐渐减小,逆反应速率逐渐增大,故B符合;
C. 升高温度瞬间,正、逆反应速率均增大,又平衡逆向移动,则逆反应速率大于正反应速率,随反应进行,正反应速率逐渐增大,逆反应速率逐渐减小,故C不符合;
D. 加催化剂正、逆反应速率同等程度增大,平衡不移动,随反应进行,速率不再变化,故D不符合;
答案选AB。
(3)常温下,向1L ![]() 的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),会发生反应
的水溶液中缓慢通入SO2气体(忽略溶液体积的变化),会发生反应![]() ,则溶液的酸性先逐渐减弱,pH逐渐增大,当二者恰好反应后,溶液变为亚硫酸溶液,酸性逐渐增强,pH又逐渐减小,当SO2通入2240mL时,二者恰好反应生成硫单质沉淀,此时溶液pH=7,即a=7,消耗的n(SO2)=0.1mol,则n(H2S)=0.2mol;未通入SO2时,溶液中主要为氢硫酸的第一步电离
,则溶液的酸性先逐渐减弱,pH逐渐增大,当二者恰好反应后,溶液变为亚硫酸溶液,酸性逐渐增强,pH又逐渐减小,当SO2通入2240mL时,二者恰好反应生成硫单质沉淀,此时溶液pH=7,即a=7,消耗的n(SO2)=0.1mol,则n(H2S)=0.2mol;未通入SO2时,溶液中主要为氢硫酸的第一步电离![]() ,
,![]() ,
,![]() ,故
,故![]() ,则
,则![]() ,故b=3.8;再继续通入SO21120mL(3360mL-2240mL=1120mL),即0.05mol时,SO2与水反应生成亚硫酸,溶液中亚硫酸的浓度为0.05mol/L,亚硫酸的电离与氢硫酸的电离类似,则同理可知:
,故b=3.8;再继续通入SO21120mL(3360mL-2240mL=1120mL),即0.05mol时,SO2与水反应生成亚硫酸,溶液中亚硫酸的浓度为0.05mol/L,亚硫酸的电离与氢硫酸的电离类似,则同理可知:![]() ,
,![]() ,则
,则![]() ,故c=1.6;
,故c=1.6;
(4)由图示可知,在SnO2电极上,O2-失电子生成氧气,则该电极为阳极,故阳极的电极反应式为![]() ,另一极Ni电极为阴极,电解池中阴极应与外接电源的负极相连。
,另一极Ni电极为阴极,电解池中阴极应与外接电源的负极相连。


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列叙述中错误的是
A.环境中杀灭新型冠状病毒可用“84”消毒液
B.食品中的抗氧化剂可用维生素C
C.治疗胃酸过多可用CaCO3和Ca(OH)2
D.除去工业废水中的Cu2+可用FeS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的( )
A.氢氧化钠与盐酸;氢氧化铜与盐酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液
D.石灰石与硝酸反应;石灰石与盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴与氢气在一定条件下反应的热化学方程式如下:
①Br2(g)+H2(g)2HBr(g) △H=-Q1kJ·mol-1
②Br2(l)+H2(g)2HBr(g) △H =-Q2kJ·mol-1
下列说法正确的是
A.Q1<Q2
B.1molHBr(g)具有的能量大于1molHBr(l)具有的能量
C.相同条件下,Cl2(g)+H2(g)2HCl(g) △H >-Q1kJ·mol-1
D.向1molBr2(g)中加入1molH2(g)在该条件下充分反应,放出Q1kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pc类似pH,是指稀溶液中离子的物质的量浓度的负对数。如溶液中某离子的物质的量浓度为![]() ,则该溶液中离子的pc=2。下列叙述正确的是( )
,则该溶液中离子的pc=2。下列叙述正确的是( )
A.用0.01mol·L-1的盐酸滴定某浓度的NaOH溶液,溶液的pH逐渐增大
B.向0.01mol·L-1的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pc(Ca2+)逐渐减小
C.0.01mol·L-1的Na2CO3溶液中,pc(Na+)=2pc(CO![]() )
)
D.常温下,纯水中pc(H+)+pc(OHˉ)=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的有机产物中有且仅有一种结构的是
A.异戊二烯![]()
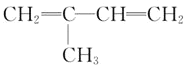
![]() 与等物质的量的
与等物质的量的![]() 发生加成反应
发生加成反应
B.2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热发生消去HCl的反应
C.甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G的结构简式为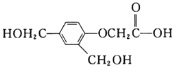 ,下列关于有机物G的说法错误的是
,下列关于有机物G的说法错误的是
A.分子式为C10H12O5
B.1 mol G与足量的金属钠反应,生成H2的体积为33.6 L
C.在一定条件下,1 mol G与足量的H2反应,最多消耗3 mol H2
D.可发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“清肺排毒汤”来源于中医经典方剂组合,对新冠肺炎病毒感染的轻型、普通型的治疗具有良好的效果。其中的一味中药黄芩,其有效成分黄芩苷的结构简式如下图所示,下列有关黄芩苷的说法中正确的是( )
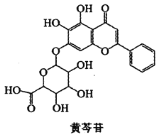
A.属于芳香族化合物,分子式为![]()
B.分子中苯环上的一氯代物有4种
C.可发生取代反应、加成反应,不能发生氧化反应
D.与足量![]() 发生加成反应后,官能团种类减少1种
发生加成反应后,官能团种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面四个反应中,反应类型与其它三个不同的是
A.CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
B.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
C.C6H5OH+3Br2 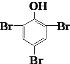 +3HBr
+3HBr
D.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com