
【题目】某物质只含C、H、O三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
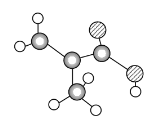
(1)该物质中含氧官能团的结构简式为________。
(2)下列物质中,与该物质互为同分异构体的是________(填序号)。
A.CH3CH2CH2COOH
B.OHCCH(CH3)CHO
C.CH3CH2CH===CHCOOH
D.CH2===CHCOOCH3
(3)该分子中共平面的原子数最多为________(已知羧基的四个原子可以共平面)。
【答案】—COOH BD 10
【解析】
根据物质成键特点可知,连有4个键的球是C,进一步判断出小白球为H,另一球为O。
(1)根据分子模型可知,该物质的结构简式为CH2===C(CH3)COOH,含氧官能团为-COOH,答案为:-COOH;
(2) A. CH3CH2CH2COOH与CH2===C(CH3)COOH分子式不同,A错误;
B. OHCCH(CH3)CHO与CH2===C(CH3)COOH分子式相同,结构不同,互为同分异构体,B正确;
C. CH3CH2CH===CHCOOH与CH2===C(CH3)COOH分子式不同,C错误;
D. CH2===CHCOOCH3与CH2===C(CH3)COOH分子式相同,结构不同,互为同分异构体,D正确;答案为:BD;
(3)碳碳双键是平面结构、羧基的四个原子可以共平面,如图所示,该分子中共平面的原子数最多为10个(标有“·”);
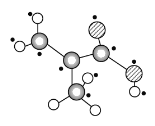
答案为:10。


科目:高中化学 来源: 题型:
【题目】某厂以甘蔗为原料制糖,对产生的大量甘蔗渣按如图所示转化进行综合利用(部分反应条件及产物没有列出)。
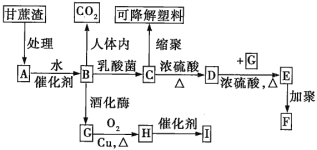
其中B是A水解的最终产物;C的分子式为C3H6O3,一定条件下2个C分子分子间脱去2分子水可生成一种六元环状化合物;D可使溴水褪色;H的三聚物I也是一种六元环状化合物。
提示:葡萄糖在乳酸菌作用下生成乳酸(![]() )。
)。
(1)C→D的反应类型为__,D→E的反应类型为__。
(2)写出A→B反应的化学方程式:_。
(3)H分子中所含官能团的名称是__,实验室中常用于检验该官能团的试剂的名称是_(只写一种)。
(4)写出下列物质的结构简式:高分子化合物F__;六元环状化合物I_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识回答下列问题:
(1)常温下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:___。
(2)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s) ΔH=-989.2kJ·mol-1,有关键能数据如下表:
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
已知1molSi中含2molSi—Si键,1molSiO2中含4molSi—O键,则x的值为__。
(3)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的是___。
(4)在稀释醋酸的过程中,下列始终保持增大趋势的量是(______)
A.c(H+) B.H+个数 C.CH3COOH分子数 D.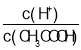
(5)某温度(t℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得混合溶液的pH=2,则a∶b=__。
(6)已知Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W 原子序数依次增大,Y 与 W 同族。X、Y、Z 三种原子最外层电子数的关系 为 X+Z=Y。电解 Z 与 W 形成的化合物的水溶液,产生 W 元素的气体单质,此气体同冷烧碱溶液作 用,可得到化合物 ZWX 的溶液。下列说法正确的是
A.W 的氢化物稳定性强于 Y 的氢化物
B.Z与其他三种元素分别形成的化合物中只含有离子键
C.Z 与 Y 形成的化合物的水溶液呈碱性
D.对应的简单离子半径大小为 W >Z > X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A.氯水中有下列平衡Cl2+H2 OHCl + HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)H2(g)+I2 (g),平衡体系增大压强可使颜色变深
C.反应CO+NO2CO2+NO ΔH <0,升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取降低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是
A.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:

(1)已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应I的热化学方程式__________________________________________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
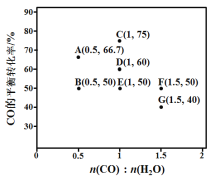
①经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=__________(填数值)。在该温度下:要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是_____
②对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是________
③比较A、B两点对应的反应速率大小:VA________VB(填“<” “=”或“>”)。反应速率v=v正v逆= K正X(CO)![]() X(H2O) –K逆X( CO2)
X(H2O) –K逆X( CO2)![]() X(H2),K正、K逆分别为反应速率常数,X为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
X(H2),K正、K逆分别为反应速率常数,X为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
![]() =__________ (计算结果保留1位小数)。
=__________ (计算结果保留1位小数)。
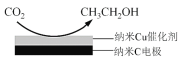
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中 =________(列出计算式)。
=________(列出计算式)。
②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变,0.1mol/L甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是( )
已知:δ(RCOOH)=![]()
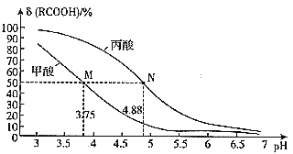
A.等浓度的HCOONa和CH3CH2COONa两种溶液中水的电离程度比较:前者>后者
B.将等浓度的HCOOH溶液与HCOONa溶液等体积混合,所得溶液中:c(HCOOH)+2c(H+)>c(OH-)+c(HCOO-)
C.图中M、N两点对应溶液中的Kw比较:前者>后者
D.1mol/L丙酸的电离常数K﹤10-4.88
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com