
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
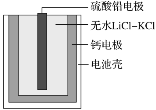
A.放电过程中,Cl-向正极移动
B.正极反应式:PbSO4+2e-=Pb+SO42-
C.反应每转移0.1mol电子,负极理论上消耗4g Ca
D.常温时,在正负极间接上电流表,指针发生偏转
【答案】B
【解析】
由原电池总反应可知Ca为原电池的负极,被氧化,反应的电极方程式为Ca-2e-=Ca2+,PbSO4为原电池的正极,发生还原反应,电极方程式为PbSO4+2e-=SO42-+Pb,原电池工作时,阳离子向正极移动,阴离子向负极移动,结合电解方程式计算。
A.放电过程为原电池,阴离子向负极移动,Cl-向负极移动,故A错误;
B.正极发生还原反应,正极反应式:PbSO4+2e-=Pb+SO42-,故B正确;
C.Ca为原电池的负极,被氧化,根据电极方程式Ca+2Cl--2e-=CaCl2,反应每转移0.1mol电子,负极理论上消耗0.05molCa,质量m=nM=0.05mol×40g/mol=2g,故C错误;
D.常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.水分子和氨气分子中,中心原子的杂化方式相同
C.2p能级有两个未成对电子和3p能级有两个未成对电子的原子对应的元素属于同一主族
D.M层全充满而N层为![]() 的原子对应的元素为K
的原子对应的元素为K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫草宁(shikonin,见下图)是从生长在亚洲学名叫Lithospermum erythrorhizon的一种植物的根部提取出来的红色化合物。几个世纪以来用做民间药物,如今用于配制治疗跌打损伤的膏药。下列说法不正确的是( )
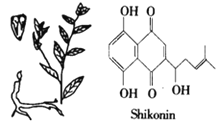
A. 紫草宁的分子式为C16H16O5
B. 等量的紫草宁与NaOH溶液、浓溴水反应,消耗NaOH、Br2 的物质的量之比为3:4
C. 紫草宁既能发生氧化反应又能发生还原反应
D. 常温下紫草宁不易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
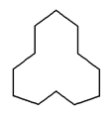
【题目】有机物的结构可以用键线式表示,式中以线示键,每个折点及线端点处表示有一个C原子,并以氢补足四价,C和H不表示出来。
(1)某物质A结构如图所示,其分子式为__,1mol该烃完全燃烧需消耗氧气__mol。
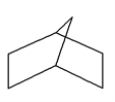
(2)降冰片烷立体结构如图所示,与它互为同分异构体的链状烯烃B,1molB与氢气完全加成,消耗的氢气是__mol;当降冰片烷发生一氯取代时,取代位置有__种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)![]() 2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.若起始时向容器中充入0.64molC,则达平衡时吸收的热量为0.12akJ
B.恒温,如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入0.64molA和0.64molB,则达平衡时n(C)<0.40mol
D.恒温、恒容,向平衡体系中再充入0.32molA,再次平衡时,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
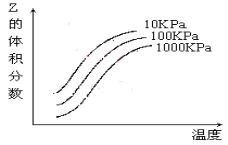
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示不正确的是( )
A.甲醛的电子式:![]()
B.间羟基苯甲酸的结构简式:![]()
C.丙烷分子的球棍模型示意图:![]()
D.3,3-二甲基-1-戊烯的键线式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac + CO + NH3Cu(NH3)3(CO)Ac。请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为________。
(2)写出基态Cu+的核外电子排布式_______。
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为______。
(4)写出与CO互为等电子体的阴离子______。(任写一个)
(5)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],1mol尿素分子中,σ键的数目为______。
(6)已知铜的晶胞结构如图所示,则在铜的晶胞中所含铜原子数及配位数比为______。
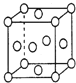
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是一种常见药物,它的相对分子质量为180,含C、H、O三种元素,其中含C、H的质量分数分别为60%、4.4%,则阿司匹林的分子式是( )
A.C10H9O4B.C10H22O3C.C9H10O4D.C9H8O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com