【题目】FeCl3是中学实验室常用的试剂。
(1)写出氯化铁在水中的电离方程式:_________。
(2)利用氯化铁溶液制备氢氧化铁胶体。
①下列制备氢氧化铁胶体的操作方法正确的是_______(填字母)。
A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体
②区别氯化铁溶液和氢氧化铁胶体的方法是___________。
(3)为了探究离子反应的本质,设计如下实验:
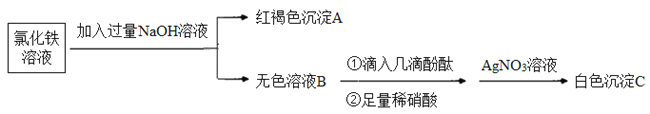
①写出生成A的离子方程式:_________。
②上述流程中,加入足量稀硝酸的目的是________。如何判定无色溶液B与稀硝酸发生了离子反应?________。
【答案】 FeCl3=Fe3++3Cl- D 做丁达尔效应实验,能产生丁达尔现象的是氢氧化铁胶体(或其他合理答案) Fe3++3OH-=Fe(OH)3↓ 中和过量的NaOH 溶液B由红色变成无色
【解析】(1)氯化铁是强电解质,在水中的电离方程式为FeCl3=Fe3++3Cl-。
(2)①实验室制备氢氧化铁胶体的操作方法是在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体,正确的是D。A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液,会生成氢氧化铁沉淀;B.加热煮沸氯化铁饱和溶液,无法控制氯化铁的水解程度,会变浑浊;C.在氨水中滴加氯化铁浓溶液,生成氢氧化铁沉淀。
②区别氯化铁溶液和氢氧化铁胶体的方法是做丁达尔效应实验,能产生丁达尔现象的是氢氧化铁胶体。
(3)为了探究离子反应的本质,该实验先向氯化铁溶液中加入过量的氢氧化钠溶液,产生了红褐色的氢氧化铁沉淀,滤液中含有氯化钠和过量的氢氧化钠,滴入酚酞后,溶液变红,加入稀硝酸后,红色逐渐变浅直至消失,说明了氢氧化钠溶液中氢氧根参加了离子反应,后来再加入硝酸银溶液后,产生了白色沉淀,只能是溶液中的氯离子与银离子发生了离子反应。
①生成A的离子方程式:Fe3++3OH-=Fe(OH)3↓。
②上述流程中,加入足量稀硝酸的目的是中和过量的NaOH。判定无色溶液B与稀硝酸发生了离子反应的依据是:溶液B由红色变成无色。

