【题目】甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
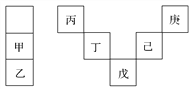
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
【答案】D
【解析】根据“己的最高价氧化物对应水化物有强脱水性”,可知己为S元素,结合元素周期表中各元素的相对位置,可得出庚为F、戊为As、丁为Si、丙为B,又由“甲和丁在同一周期,甲原子最外层与最内层具有相同电子数”,说明甲为Mg、乙为Ca。A、丙(5B)与戊(33As) 的原子序数相差28,选项A错误;B、元素的非金属性越强,其对应气态氢化物的稳定性越强,因非金属性:庚(F)>己(S)>戊(As),则有稳定性:庚(HF)>己(H2S)>戊(AsH3),选项B错误;C、常温下,镁与水反应很缓慢,钙能与水剧烈反应,选项C错误;D、丁(Si)的最高价氧化物(SiO2)可用于制造光导纤维,选项D正确。答案选D。

