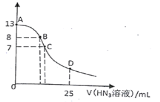
【题目】常温下,向25 mL 0.1 mol·L-1NaOH溶液中逐滴滴加0.2 mol·L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是
A. 0.1 mol·L-1 NaN3溶液pH约为8.85
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)<12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
【答案】A
【解析】
A.叠氮酸根的水解反应的平衡常数K=Kw/Ka(HN3)=[c(HN3)·c(OH-)]/ c(N3-)= c(OH-)2/ c(N3-),即![]() ,解得c(OH-)=10-5.15,所以c(H+)=10-8.85,则pH约为8.85,故A正确;
,解得c(OH-)=10-5.15,所以c(H+)=10-8.85,则pH约为8.85,故A正确;
B.B点呈碱性,则c(OH-)>c(H+),由于pH=8,混合液中的氢离子、氢氧根离子浓度较小,则正确的离子浓度大小为:c(Na+)>c(N3-)>c(OH-)>c(H+),故B错误;
C.滴加的V(HN3)=12.5 mL时,恰好反应生成NaN3,N3-部分水解,溶液呈碱性,而C点溶液的pH=7,所以C点V(HN3)>12.5 mL,故C错误;
D.D点溶液中,c(NaN3)=c(HN3),根据物料守恒,2c(Na+)=c(HN3)+c(N3-),D项错误;
故选A。

