【题目】钼(Mo)是一种重要的过渡金属元素,在电子行业有可能取代石墨烯,其化合物钼酸钠晶体(Na2MoO42H2O)可制造阻燃剂和无公害型冷水系统的金属抑制剂。由钼精矿(主要成分MoS2,含有少量不反应杂质)制备钼及钼酸钠晶体的工艺流程如下:

(1)焙烧时,下列措施有利于使钼精矿充分反应的是________(填序号)。
a 增大钼精矿的量 b 将矿石粉碎 c 采用逆流原理混合
(2)操作1的名称是______,“碱浸”过程中反应的离子方程式为________。
(3)经“蒸发结晶”过程可得到钼酸钠晶体的粗品,要得到纯净的钼酸钠晶体,需要进行的操作2名称是_________。
(4)Mo元素有+4、+6两种价态,钼精矿中存在非整比晶体MoS2.7,则MoS2.7中Mo4+所占Mo元素的物质的量分数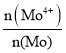 为__________。
为__________。
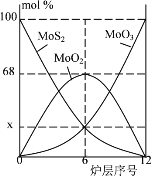
(5)焙烧钼精矿所用的装置是多层焙烧炉,如图为各炉层固体物料的物质的量的百分组成。图像中纵坐标x =_____。
(6)在实际生产中会有少量SO42-生成,用固体Ba(OH)2除去。在除SO42-前测定碱浸液中c(MoO42-)=0.80mol·L-1, c(SO42-)=0.04mol·L-1,当BaMoO4开始沉淀时,SO42-的去除率为94.5%,则Ksp(BaMoO4)=_________。[ Ksp(BaSO4)= 1.1×10-10,溶液体积变化、温度变化可忽略。]
【答案】bc 过滤 MoO3+CO32-=MoO42-+CO2↑ 重结晶 0.3 16 4.0×10-8
【解析】
灼烧钼精矿,MoS2燃烧,反应方程式为2MoS2+7O2![]() 2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,经过过滤操作除去不反应的杂质,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO42H2O。将过滤后的溶液足量HCl,将Na2MoO4转化为H2MoO4,H2MoO4高温下发生分解生成MoO3,MoO3高温下被氢气还原为金属钼,据此分析解答相关问题。
2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,经过过滤操作除去不反应的杂质,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO42H2O。将过滤后的溶液足量HCl,将Na2MoO4转化为H2MoO4,H2MoO4高温下发生分解生成MoO3,MoO3高温下被氢气还原为金属钼,据此分析解答相关问题。
(1)焙烧时,使钼精矿充分反应的即提高原料的利用率,使原料尽可能全部转化,则可以粉碎原料,增大原料与氧气的接触面积,还可以将焙烧后的原料循环再次煅烧,故答案选bc;
(2)根据分析,操作1的名称是过滤,除去矿石中不参与反应的杂质物质,“碱浸”过程中反应的离子方程式为MoO3+CO32-=MoO42-+CO2↑;
(3)根据制备流程分析,经“蒸发结晶”过程可得到钼酸钠晶体的粗品,要得到纯净的钼酸钠晶体,需要进行的操作2名称是重结晶;
(4)设MoS2.7的物质的量为1mol,其中+4、+6两种价态的Mo的物质的量分别为xmol和ymol,则Mo的物质的量为1mol=xmol+ymol,再根据MoS2.7化合价为零,则4x+6y+(-2)×2.7=0,解方程组可得:x=0.3,y=0.7,则MoS2.7中Mo4+所占Mo元素的物质的量分数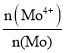 为
为![]() =0.3;
=0.3;
(5)焙烧钼精矿反应方程式为2MoS2+7O2![]() 2MoO3+4SO2,由图可知,6层中存在的固体物质分别为MoS2、MoO3、MoO2,图象分析MoO2的物质的量百分比为68%,根据Mo元素守恒,则MoS2、MoO3的物质的量百分比均为16%,则x为16;
2MoO3+4SO2,由图可知,6层中存在的固体物质分别为MoS2、MoO3、MoO2,图象分析MoO2的物质的量百分比为68%,根据Mo元素守恒,则MoS2、MoO3的物质的量百分比均为16%,则x为16;
(6)在实际生产中会有少量SO42-生成,用固体Ba(OH)2除去。在除SO42-前测定碱浸液中c(MoO42-)=0.80mol·L-1,c(SO42-)=0.04mol·L-1,当BaMoO4开始沉淀时,SO42-的去除率为94.5%,即溶液中剩余c(SO42-)= 0.04mol·L-1×(1-94.5%)=0.0022 mol·L-1,Ksp(BaSO4)= 1.1×10-10= c(SO42-)×c(Ba2+),c(Ba2+)=![]() =5×10-8 mol·L-1,则Ksp(BaMoO4)= c(MoO42-) ×c(Ba2+)=0.80mol·L-1×5×10-8 mol·L-1=4.0×10-8。
=5×10-8 mol·L-1,则Ksp(BaMoO4)= c(MoO42-) ×c(Ba2+)=0.80mol·L-1×5×10-8 mol·L-1=4.0×10-8。

