【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界。________
(2)表中最活泼的金属与最活泼的非金属形成的物质是________(填化学式)。
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_______,这两种化合物中所含的化学键有______(填字母)。
A.极性共价键 B.非极性共价键 C.离子键
(4) e、f、k、m对应的单原子离子的半径由大到小的顺序为____________(填离子符号)。
(5) d、m对应的离子还原性由强到弱顺序为__________(填离子符号)。
(6) d、e、m的气态氢化物中,最不稳定的是__________(填分子式)。
参考答案:
【答案】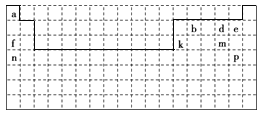 KF 2H2O2
KF 2H2O2 2H2O+O2↑ AB S2->F->Na+>Al3+ S2->O2- H2S
2H2O+O2↑ AB S2->F->Na+>Al3+ S2->O2- H2S
【解析】
根据周期表的结构,可以推知各元素分别为:a为H,b为C,d为O,e为F,f为Na,k为Al,m为S,n为K,p为Br。
(1)到现在为止,元素周期表已经排了118种元素,所以元素周期表的下边界是最底下一条实线。上边界从氢开始,第一周期只有氢和氦两种元素,氢在第1纵行,氦在第18纵行。第二、三周期从碱金属元素开始,位于第1纵行,第ⅡA族的铍和镁在第2纵行,第3~10纵行没有元素,从第11纵行开始,一直到第18纵行,分别排了从第ⅢA族到0族的10种元素。第四周期共18种元素,占据了18个纵行,所以实线表示的元素周期表的上下边界如图: 。
。
(2)表中最活泼的金属是K,最活泼的非金属是F,两者形成的物质是KF。
(3)由a、d两种元素可形成两种化合物有H2O和H2O2,H2O2可以分解为水和氧气,化学方程式为2H2O2 2H2O+O2↑,H2O中只含极性共价键,H2O2中除了O和H之间的极性共价键之外,还有两个氧原子之间的非极性共价键,故选AB。
2H2O+O2↑,H2O中只含极性共价键,H2O2中除了O和H之间的极性共价键之外,还有两个氧原子之间的非极性共价键,故选AB。
(4)e、f、k、m对应的单原子离子分别为F-、Na+、Al3+、S2-,F-、Na+、Al3+的电子层为2层,S2-的电子层是3层,电子层数越多,半径越大,电子层数相同时,质子数越多,半径越小,所以F-、Na+、Al3+、S2-的半径由大到小的顺序为S2->F->Na+>Al3+。
(5)d、m对应的离子分别为O2-、S2-,O的非金属性强于S,所以O2-的还原性弱于S2-。
(6)d、e、m的气态氢化物分别为H2O、HF、H2S,氢化物的稳定性和非金属性一致,在O、F、S这三种元素中,S的非金属性最弱,所以H2S最不稳定。
-
科目: 来源: 题型:
查看答案和解析>>【题目】元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶胞结构如图所示。下列说法中错误的是( )
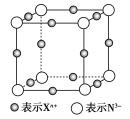
A.晶体中每个Xn+周围有2个等距离且最近的N3-
B.该晶体中阳离子与阴离子的个数比为3︰1
C.n=1
D.Xn+的核外电子数为18
-
科目: 来源: 题型:
查看答案和解析>>【题目】对可逆反应2A(s)+3B(g)
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( ) ①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】某有机物结构简式为
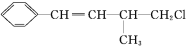 ,下列叙述不正确的是( )
,下列叙述不正确的是( )A.1mol该有机物在加热和催化剂作用下,最多能和4molH2反应
B.该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C.该有机物在一定条件下能发生消去反应或取代反应
D.该有机物遇硝酸银溶液产生白色沉淀
-
科目: 来源: 题型:
查看答案和解析>>【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法正确的是
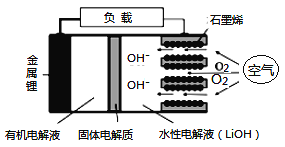
A. Li+穿过固体电解质向正极移动而得到LiOH溶液
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. 放电时,负极反应式:Li-e-+OH-=LiOH
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制溴苯可用如图装置。回答下列问题:
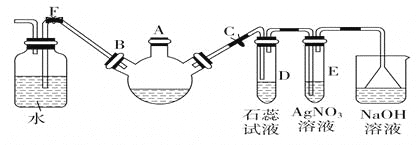
(1)关闭F夹,打开C夹,向装有少量苯的三口烧瓶的A口加少量溴,再加少量铁屑,塞住A口,则三口烧瓶中发生的有机化学反应方程式为_______________________。
(2)D试管内出现的现象为________________;E试管内出现的现象为________________。
(3)待三口烧瓶中仍有气泡冒出时打开F夹,关闭C夹,可看到的现象是_____________________。
(4)从溴苯中除去溴,用NaOH溶液处理后再洗涤,反应的离子方程式为 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
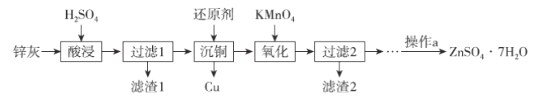
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g
起始滴定管读数/mL
终点滴定管读数/mL
0.1692
0.20
26.50
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。
相关试题

