
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
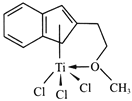
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
【答案】 3d24s2 3 Ti原子的价电子数比Al多,金属键更强 [TiCl(H2O)5]2+ 氧 sp2 sp3 c BD 0.81a 0.5c ![]()
【解析】试题分析:(1)钛原子核外有22个电子,根据核外电子排布规律写基态钛原子的价电子排布式;基态原子的未成对电子数为2;第四周期中未成对电子数为2的元素有Ge、Se、Ni,有3种;(2) Ti原子的价电子数是4、铝原子的价电子数是3;(3).配位数为6,两种配体的物质的量之比为1:5,所以配体中有1个氯原子、5个水分子;(4) ①组成M的元素有Ti、C、H、O、Cl,非金属性越强电负性越大;②M中有双键碳和单键碳原子两种;③单键为σ键、双键中1个是σ键、1个是π键,根据M的结构图,还有配位键;(5) ①根据均摊原则,晶胞中共有原子![]() ,晶胞中相同位置的原子相同,根据钛氧原子比是1:2分析;②根据晶胞结构分析D原子坐标;根据图示,
,晶胞中相同位置的原子相同,根据钛氧原子比是1:2分析;②根据晶胞结构分析D原子坐标;根据图示,![]()
解析:(1)钛原子核外有22个电子,基态钛原子的价电子排布式为3d24s2;基态钛原子的未成对电子数为2;第四周期中未成对电子数为2的元素还有3种,分别是Ge、Se、Ni; (2) Ti原子的价电子数是4、铝原子的价电子数是3,Ti原子的价电子数比Al多,金属键更强,所以钛的硬度比铝大;(3).配位数为6,两种配体的物质的量之比为1:5,所以配体中有1个氯原子、5个水分子,所以该配合离子的化学式为[TiCl(H2O)5]2+;(4) ①组成M的元素有Ti、C、H、O、Cl,其中O的非金属性最强,非金属性越强电负性越大,所以电负性最大的是氧;②M中有双键碳和单键碳原子两种,所以M中碳原子的杂化方式为sp2、 sp3;③单键为σ键、双键中1个是σ键、1个是π键,根据M的结构图,还有配位键,没有离子键,故选c;(5) ①根据均摊原则,晶胞中共有原子![]() ,晶胞中相同位置的原子相同,根据钛氧原子比是1:2,可知氧原子是BD;②根据晶胞结构,若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D原子坐标是(0.19a,0.81a,0.5c);根据图示,
,晶胞中相同位置的原子相同,根据钛氧原子比是1:2,可知氧原子是BD;②根据晶胞结构,若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D原子坐标是(0.19a,0.81a,0.5c);根据图示,![]() ,则d=
,则d=![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
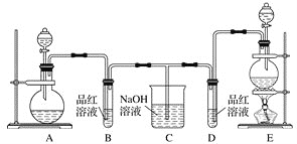
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是________(填字母),反应中浓盐酸所表现出的化学性质是________________和________________。
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,__________(填“B”或“D”)试管中无明显现象。
(3)装置C的作用是____________________。
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是__________________。
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
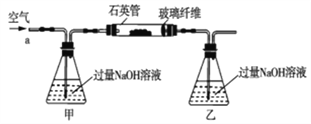
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
(实验一)测定硫元素的含量
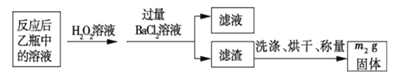
反应结束后,将乙瓶中的溶液进行如下处理:
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是
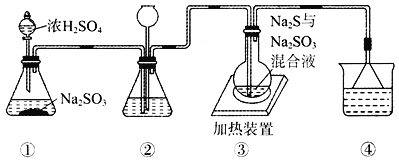
A. 装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液
B. 为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则![]()
C. 装置④的作用是吸收尾气,同时防止倒吸
D. 装置①也可用于高锰酸钾与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:
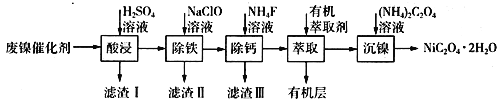
(1)请写出一种能提高“酸浸”速率的措施:________________________;滤渣I的成分是____________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
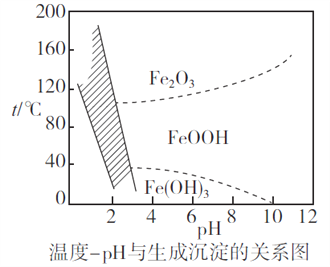
①若控制温度40℃、pH=8,则滤渣II的主要成分为_________________________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_________mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要________________________。
②该镀镍试剂的化学式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一块生铁块,放置一段时间。下列有关描述正确的是
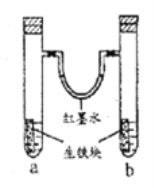
A. 生铁块中的碳是原电池的负极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe-2e-=Fe2+
D. a试管中发生了析氢腐蚀,b试管中发生了吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是
A.CaCl2=Ca2++2Cl—B.K2SO4=2K ++SO42—
C.HNO3=H++NO3—D.NaClO=Na++Cl-+O2—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com