【题目】下列说法正确的是( )
A. 将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a
B. 常温下0.1 molL-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A)
C. 室温时 M(OH)2(s)![]() M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +
M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +![]() 1g
1g![]()
D. 0.1 molL-1 Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
参考答案:
【答案】C
【解析】A.加水稀释氢氧化钠溶液和氨水中c(OH-)都变小,加水稀释促进一水合氨电离,则稀释后氨水的pH大于氢氧化钠,则a、b、c的大小关系是:a>c>b,故A错误;B.常温下0.1 molL-1 KHA溶液的pH=3,说明HA-在溶液中部分电离出氢离子,且HA-的电离程度大于其水解程度,则c(A2-)>c(H2A),故B错误;
C.Ksp=c(M2+)×c2(OH-)=a,则c(OH-)=![]() mol/L,常温下氢离子浓度为:c(H+)=
mol/L,常温下氢离子浓度为:c(H+)=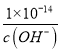 ,则该溶液的pH=-lgc(H+)=-lg
,则该溶液的pH=-lgc(H+)=-lg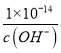 =-lg-lg
=-lg-lg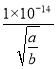 =14 +
=14 +![]() 1g
1g![]() ,故C正确;D.0.1 molL-1 Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D错误;答案为C。
,故C正确;D.0.1 molL-1 Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D错误;答案为C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲烷分子中C—H键的键角为
A.120O20’B.112 O30’C.109 O28’D.60 O.
-
科目: 来源: 题型:
查看答案和解析>>【题目】有机物C11H16中苯环上有两个侧链的同分异构体的数目为(不考虑立体结构)( )
A. 12 B. 24 C. 20 D. 18
-
科目: 来源: 题型:
查看答案和解析>>【题目】若在加入铝粉能放出H
 的溶液中,下列各组离子一定不能大量共存的是
的溶液中,下列各组离子一定不能大量共存的是A. Na
 、Fe
、Fe 、SO
、SO 、Cl
、Cl
B. Ba
 、Mg
、Mg 、HCO
、HCO 、NO
、NO
C. Na
 、K
、K 、NO
、NO 、CO
、CO
D. K
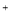 、NO
、NO 、AlO
、AlO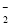 、OH
、OH
-
科目: 来源: 题型:
查看答案和解析>>【题目】r—Fe2O3是一种具有磁性、催化、气敏的纳米材料。一种以硫铁矿烧渣等为原料制备r—Fe2O3的流程如下:

(1)下列有关“还原焙烧”工序的说法正确的是_____(填字母)。
a.焦炭应少量,空气应过量
b. 焙烧过程均为吸热反应,需用电炉持续加热反应器
c.“还原焙烧”的主要反应为 3C+2O2
 2CO+CO2、Fe2O3+CO
2CO+CO2、Fe2O3+CO 2FeO+CO2
2FeO+CO2(2)“浸取”前需将焙烧生成的熔体粉碎,其目的是_____________________。
(3)已知三种金属离子开始沉淀和完全沉淀的pH如下表:
Fe3+
Fe2+
Al3+
开始沉淀的pH
2.2
7.5
4.1
完全沉淀的pH
3.5
9.5
5.4
则“调pH”时,溶液的pH范围为_______________。
(4)滤渣1的主要成分为_________(填化学式);“沉铁”时发生反应的离子方程式为___________。
(5)“过滤2”时需用蒸馏水洗涤,能证明沉淀已洗涤干净的方法是_________;沉淀缓慢氧化为铁黄的化学方程式为________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
A. 10mL0.1mol/L的CH3COOH溶液中氧原子数为0.002NA
B. 0.2mol/L的NaCl溶液中,Na+数为0.2NA
C. 0.1mol的Na2O2与足量的CO2反应,转移电子数为0.1NA
D. 在标准状况下4.48L的CH2Cl2其分子数为0.2NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)为快速得到乙醇气体,可采取的方法是 ;
若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是 (填写编号);
a.取下小试管 b.移去酒精灯 c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中出现的现象为 。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。

①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有Fe2+和Fe3+,检验该溶液中的Fe2+的方法是 ;
关于M中铁元素价态的判断正确的是 (填写编号)。
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3和+2价铁,可能有0价铁
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置和步骤如下:

①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是 (填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧ c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中
 = 。
= 。
相关试题

