【题目】(1)写出铁与水蒸气在高温下反应方程式___________________________。
(2)常温下,铜在潮湿的空气里会被锈蚀,有关化学方程式为___________________________________。
(3)在呼吸面具中,Na2O2 起反应的化学方程式为____________________________________。当有7.8克Na2O2反应时,放出氧气的质量为____________。
(4)将6.4g的铜片投入到100ml的FeCl3溶液中恰好完全反应,发生的反应离子方程式为______________________________________, FeCl3溶液的物质的量浓度______________。
(5)向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出此变化过程的化学方程式:_________________________________________。
参考答案:
【答案】 3Fe + 4H2O(g)![]() Fe3O4 + 4H2 2Cu + O2 +CO2 + H2O =Cu2(OH)2CO3 2Na2O2 + 2CO2 == 2Na2CO3 + O2 1.6克 2Fe3+ + Cu = 2Fe2+ + Cu2+ 2mol/L FeSO4 + 2NaOH = Fe(OH)2 ↓+ Na2SO4, 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe3O4 + 4H2 2Cu + O2 +CO2 + H2O =Cu2(OH)2CO3 2Na2O2 + 2CO2 == 2Na2CO3 + O2 1.6克 2Fe3+ + Cu = 2Fe2+ + Cu2+ 2mol/L FeSO4 + 2NaOH = Fe(OH)2 ↓+ Na2SO4, 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
【解析】试题分析:(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气;(2)常温下,铜在潮湿的空气里会与氧气、二氧化碳反应生成Cu2(OH)2CO3;(3)在呼吸面具中,Na2O2与二氧化碳反应放出氧气;根据方程式计算7.8克Na2O2反应时,放出氧气的质量;(4)铜片投入FeCl3溶液中生成氯化亚铁和氯化铜;根据反应方程式计算FeCl3溶液的物质的量浓度;(5)FeSO4溶液中滴加NaOH溶液时,生成的白色Fe(OH)2沉淀,Fe(OH)2被氧气氧化为红褐色Fe(OH)3沉淀。
解析:(1)铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应方程式是3Fe + 4H2O(g)![]() Fe3O4 + 4H2 ;(2)常温下,铜在潮湿的空气里会与氧气、二氧化碳反应生成Cu2(OH)2CO3,反应方程式是2Cu + O2 +CO2 + H2O =Cu2(OH)2CO3;(3)在呼吸面具中,Na2O2与二氧化碳反应生成碳酸钠和氧气,反应方程式是2Na2O2 + 2CO2 == 2Na2CO3 + O2;
Fe3O4 + 4H2 ;(2)常温下,铜在潮湿的空气里会与氧气、二氧化碳反应生成Cu2(OH)2CO3,反应方程式是2Cu + O2 +CO2 + H2O =Cu2(OH)2CO3;(3)在呼吸面具中,Na2O2与二氧化碳反应生成碳酸钠和氧气,反应方程式是2Na2O2 + 2CO2 == 2Na2CO3 + O2;
设 7.8克Na2O2反应时,放出氧气的质量为xg
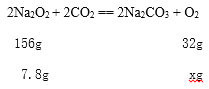
![]() , x=1.6g;
, x=1.6g;
(4)铜片投入FeCl3溶液中生成氯化亚铁和氯化铜,反应离子方程式是2Fe3+ + Cu = 2Fe2+ + Cu2+;设100ml FeCl3溶液中含有FeCl3的物质的量是xmol;
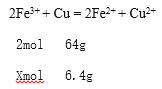
![]() ,x=0.2mol;FeCl3溶液的物质的量浓度为
,x=0.2mol;FeCl3溶液的物质的量浓度为![]() ;(5)FeSO4溶液中滴加NaOH溶液时,生成的白色Fe(OH)2沉淀,反应方程式是FeSO4 + 2NaOH = Fe(OH)2 ↓+ Na2SO4,Fe(OH)2被氧气氧化为红褐色Fe(OH)3沉淀,反应方程式是4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。
;(5)FeSO4溶液中滴加NaOH溶液时,生成的白色Fe(OH)2沉淀,反应方程式是FeSO4 + 2NaOH = Fe(OH)2 ↓+ Na2SO4,Fe(OH)2被氧气氧化为红褐色Fe(OH)3沉淀,反应方程式是4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图装置可以用来制取某些气体.
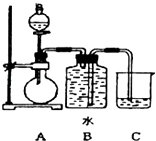
(1)该装置可以制备乙炔气体,圆底烧瓶中盛放的物质是(填电子式)分液漏斗中盛放的是 , 目的是 .
(2)实验室中制备乙炔的反应原理是 .
(3)用此方法制取的乙炔气体通常混有H2S气体,如何除去?(填化学试剂)
(4)还能用该装置制备和收集的气体有(答出任意一种即可) .
(5)若用来制备乙烯气体,需要对装置进行改进,将分液漏斗改成温度计,温度计的水银球放置的位置是 , 改进时还需要的玻璃仪器是 . -
科目: 来源: 题型:
查看答案和解析>>【题目】5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
阳离子
Na+ Al3+Fe3+ Cu2+、Ba2+
阴离子
OH﹣ Cl﹣ CO32﹣ NO3﹣ SO4﹣
分别取它们的水溶液进行实验,结果如下:①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3 , 沉淀部分溶解,剩余白色固体;②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6molL﹣1稀H2SO4 , Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断A、C的化学式为:A;C .
(2)写出步骤②中发生反应的化学方程式 .
(3)D溶液中滴入石蕊试液,现象是 , 原因是(用离子方程式说明).
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是mL.
(5)现用500mL 3molL﹣1的E溶液充分吸收11.2L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为 .
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水).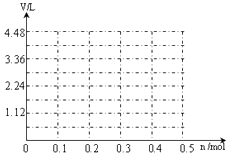
-
科目: 来源: 题型:
查看答案和解析>>【题目】在密闭容器中充入4mol SO2和3mol O2 一定条件下建立平衡2SO2(g)+O2(g)═2SO3(g)△H=﹣Q KJ/mol,测得SO2的转化率为90%,则在此条件下,反应放出的热量为( )
A.1.8Q KJ
B.2Q KJ
C.Q KJ
D.0.9Q KJ -
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述正确的是( )
A. 固体氯化钠不导电,所以氯化钠是非电解质
B. 铜丝能导电,所以铜是电解质
C. 氯化氢水溶液能导电,所以氯化氢是电解质
D. CO2溶于水能导电,所以CO2是电解质
-
科目: 来源: 题型:
查看答案和解析>>【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)2Z(g)(△H<0).为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z.
A.①③⑤
B.②③⑤
C.②③⑥
D.②④⑥ -
科目: 来源: 题型:
查看答案和解析>>【题目】现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液 蒸馏 萃取
B.萃取 蒸馏 分液
C.分液 萃取 蒸馏
D.蒸馏 萃取 分液
相关试题

