【题目】工业上用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:
CH3OH(g)+H2O(g)实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:
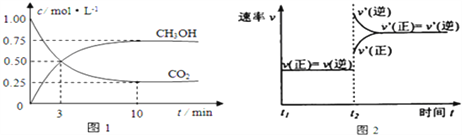
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= ______ 。图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为 _____ 反应(填“放热”或“吸热”)。
(2)下列各项能作为判断该反应达到平衡标志的是____(填序号字母)。
A.容器内压强保持不变 B.v正(CO2)=3v逆(H2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
(3)500℃该反应的平衡常数为 ______ (保留两位小数),若提高温度到 800℃进行,达平衡时,K值 ______ (填“增大”“减小”或“不变”).
(4)下列措施中不能使CO2的转化率增大的是 ______ 。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离
(5)500℃,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正) ______ v(逆)(填“>”“<”或“=”)。
(6)下列措施能使n(CH3OH)/n(CO2)增大的是 ______ 。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
参考答案:
【答案】 0.225mol/(Lmin) 放热 A C 5.33 减小 BD > CD
【解析】试题分析:本题考查图像的分析,化学反应速率的计算,化学平衡的标志,化学平衡常数的计算和应用,外界条件对化学平衡的影响。
(1)由图1可知从开始到平衡CO2物质的量浓度由1.00mol/L减小到0.25mol/L,υ(CO2)=(1.00mol/L-0.25mol/L)![]() 10min=0.075mol/(L·min),则υ(H2)=3υ(CO2)=3
10min=0.075mol/(L·min),则υ(H2)=3υ(CO2)=3![]() 0.075mol/(L·min)=0.225mol/(L·min)。由图2知,改变温度,正、逆反应速率都加快说明为升高温度,逆反应速率大于正反应速率,即升高温度平衡向逆反应方向移动,逆反应为吸热反应,则该反应的正反应为放热反应。
0.075mol/(L·min)=0.225mol/(L·min)。由图2知,改变温度,正、逆反应速率都加快说明为升高温度,逆反应速率大于正反应速率,即升高温度平衡向逆反应方向移动,逆反应为吸热反应,则该反应的正反应为放热反应。
(2)A项,该反应的正反应为气体分子数减小的反应,建立平衡过程中气体物质的量减小,容器内压强减小,平衡时气体物质的量不变,容器内压强不变,容器内压强保持不变能说明反应达到平衡状态;B项,υ正(CO2)=3υ逆(H2),表明正、逆反应速率不相等,反应没有达到平衡状态;C项,容器内CO2的体积分数不变表明反应达到平衡状态;D项,气体的总质量始终不变,容器的体积不变,混合气体的密度始终不变,混合气体的密度保持不变不能说明反应达到平衡状态;能说明反应达到平衡状态的是A、C,答案选AC。
(3)结合图1,用三段式
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
c(起始)(mol/L)1.00 3 0 0
c(转化)(mol/L)0.75 2.25 0.75 0.75
c(平衡)(mol/L)0.25 0.75 0.75 0.75
500℃该反应的平衡常数为![]() =5.33。该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数K值减小。
=5.33。该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,化学平衡常数K值减小。
(4)A项,在原容器中再充入1mol H2,平衡向正反应方向移动,CO2的转化率增大;B项,在原容器中再充入1molCO2,平衡向正反应方向移动,根据勒夏特列原理(改变影响平衡的一个条件,平衡向着减弱这种改变的方向移动,但不能消除这种改变),CO2的转化率减小;C项,缩小容器的容积,平衡向正反应方向移动,CO2的转化率增大;D项,使用更有效的催化剂,平衡不移动,CO2的转化率不变;E项,将水蒸气从体系中分离,平衡向正反应方向移动,CO2的转化率增大;不能使CO2转化率增大的是B、D,答案选BD。
(5)此时刻的浓度商为![]() =4
=4![]() 5.33,反应正向进行,υ(正)
5.33,反应正向进行,υ(正)![]() υ(逆)。
υ(逆)。
(6)A项,升高温度,平衡向逆反应方向移动,n(CH3OH)/n(CO2)减小;B项,在原容器中充入1molHe,由于各物质的浓度没有改变,平衡不发生移动,n(CH3OH)/n(CO2)不变;C项,将水蒸气从体系中分离出,减小生成物浓度,平衡向正反应方向移动,n(CH3OH)/n(CO2)增大;D项,缩小容器容积,增大压强,平衡向正反应方向移动,n(CH3OH)/n(CO2)增大;能使n(CH3OH)/n(CO2)增大的是C、D,答案选CD。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列解释事实的离子方程式不正确的是
A. 铝片放入NaOH 溶液中有气体产生: 2Al+ 2OH-+ 2H2O=2AlO2-+3H2↑
B. 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72-(橙色)+ H2O
 2CrO42-(黄色) + 2H+
2CrO42-(黄色) + 2H+C. 用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4 + CO32-
 CaCO3+ SO42-
CaCO3+ SO42-D. 向Na2SiO3溶液中通入过量CO2制各硅酸凝胶:SiO32-+ CO2 + H2O=H2SiO3(胶体) + CO32-
-
科目: 来源: 题型:
查看答案和解析>>【题目】依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
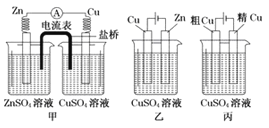
A. 甲是原电池,乙是电镀装置 B. 甲、乙装置中,锌极上均发生氧化反应
C. 乙、丙装置中,阳极均发生氧化反应而溶解 D. 丙装置中,铜电极的质量有增有减
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验:①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是( )
A. 浊液a中存在沉淀溶解平衡:AgCl(s)
 Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)B. 滤液b中不含有Ag+
C. ③中颜色变化说明AgCl转化为AgI
D. 实验可以证明AgI比AgCl更难溶
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法中正确的是
A. 水是极弱的电解质,它能微弱电离生成
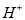 ,所以严格地说纯水呈微酸性
,所以严格地说纯水呈微酸性B. 向水中加入稀氨水,平衡逆向移动,
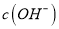 降低
降低C.
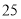 ℃纯水中
℃纯水中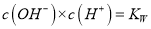 ,稀酸和稀碱中
,稀酸和稀碱中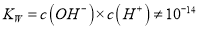
D.
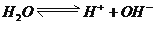 是吸热过程,所以温度升高,平衡向电离方向移动,
是吸热过程,所以温度升高,平衡向电离方向移动, 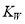 随之增大
随之增大 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中既有极性键,又有非极性键的非极性分子是( )
A. 二氧化碳 B. 四氯化碳 C. 双氧水 D. 乙炔
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g)
 CO(g)+H2(g) K1;
CO(g)+H2(g) K1;Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;Ⅲ.CaO(s)+CO2(g)
 CaCO3(s) K3;
CaCO3(s) K3;燃烧炉中涉及的反应为
Ⅳ.C(s)+O2(g)===CO2;
Ⅴ.CaCO3(s)===CaO(s)+CO2(g)。
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气(H216O),达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为________;向该容器中补充a mol炭,水蒸气的转化率将________(填“增大”、“减小”或“不变”),再补充a mol水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为__________。
(3)已知反应Ⅱ的ΔH=-41.1 kJ/mol,C≡O 、O—H、H—H键的键能分别为1072.9 kJ/mol,464 kJ/mol、436 kJ/mol,则C=O的键能为________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡________移动(填“向右”、“向左”或“不”);当重新平衡后,CO2浓度________(填“变大”、“变小”或“不变”)。
相关试题

