【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
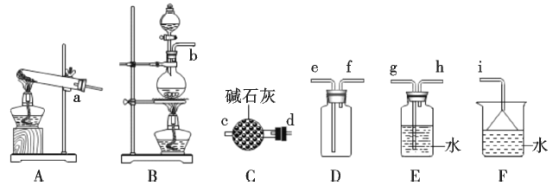
(1)氨气的制备
①氨气的发生装置中反应的化学方程式为__。装置C的仪器名称__。
②欲收集一瓶干燥的氨气,选择上图中的装置,其接口连接顺序为a→__(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
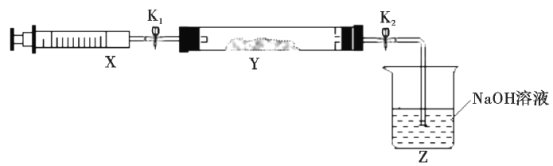
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中__ | ②反应的化学方程式___ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③__ | ④___ |
【答案】![]() 干燥管 d→c→f→e→i(或d→c→f→e→d→c→i) 红棕色气体逐渐变浅
干燥管 d→c→f→e→i(或d→c→f→e→d→c→i) 红棕色气体逐渐变浅 ![]() Z中的NaOH溶液产生倒吸现象 反应气体经冷却后气体分子数减少,Y管中压强小于外压
Z中的NaOH溶液产生倒吸现象 反应气体经冷却后气体分子数减少,Y管中压强小于外压
【解析】
(1)①实验室用加热固体氯化铵和氢氧化钙的方法制备氨气,依据反应物状态和条件选择发生装置;根据实验装置图识别仪器名称;
②气体制备一般顺序为:发生装置→净化装置→收集装置→尾气处理装置,结合氨气为碱性气体、密度小于空气密度、极易溶于水的性质解答;
(2)打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应生成无色氮气,所以看到现象为:红棕色变浅;依据8NH3+6NO2=7N2+12H2O以及气态水凝聚判断反应后气体分子数减少从而判断打开K2发生的现象。
(1)①实验室用加热固体氯化铵和氢氧化钙的方法制备氨气,反应物状态为固体与固体,反应条件为加热,所以选择A为发生装置,反应方程式:![]() ;仪器C的名称为干燥管;
;仪器C的名称为干燥管;
②实验室用加热固体氯化铵和氢氧化钙的方法制备氨气,制备的气体中含有水蒸气,氨气为碱性气体,应选择盛有碱石灰干燥管干燥气体,氨气极易溶于水,密度小于空气密度,所以应选择向下排空气法收集气体,氨气极易溶于水,尾气可以用水吸收,注意防止倒吸的发生,所以正确的连接顺序为:a→d→c→f→e→i(或a→d→c→f→e→d→c→i);
(2)打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中,则氨气与二氧化氮发生归中反应生成无色氮气,所以看到现象为:红棕色气体慢慢变浅;NH3中N元素处于最低价,NO2中N元素处于较高价态,二者能够发生归中反应生成N2,根据转移电子守恒以及原子守恒可知化学反应方程式为:![]() ;装置恢复至室温后,根据气态水凝聚可判断反应后气体分子数减少,装置内压强降低,所以打开K2在大气压的作用下发生倒吸,故答案为:红棕色气体慢慢变浅;
;装置恢复至室温后,根据气态水凝聚可判断反应后气体分子数减少,装置内压强降低,所以打开K2在大气压的作用下发生倒吸,故答案为:红棕色气体慢慢变浅;![]() ;Z中NaOH溶液产生倒吸现象;反应气体经冷却后气体分子数减少,Y管中压强小于外压。
;Z中NaOH溶液产生倒吸现象;反应气体经冷却后气体分子数减少,Y管中压强小于外压。

