【题目】常温下,0.1mol/L的三种盐溶液,NaX、NaY、NaZ的pH分别为7、8、9,则下列判断中正确的是
A. HX、HY、HZ的酸性依次增强
B. 离子浓度:c(Z-)>c(Y-)>c(X-)
C. 电离常数:K(HZ)<K(HY)
D. c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ)
参考答案:
【答案】CD
【解析】
A. NaX、NaY、NaZ的pH分别为7、8、9,NaX 为强酸强碱盐,没有水解;NaY、NaZ为强碱弱酸盐,水解显碱性,碱性越强,水解程度越大,其对应的酸性越弱, HX、HY、HZ的酸性依次减弱,所以A错;B. 离子浓度:c(Z-)>c(Y-)>c(X-) NaY、NaZ为强碱弱酸盐,水解显碱性,碱性越强,水解程度越大,其离子浓度越小,离子浓度:c(Z-)<c(Y-)<c(X-)
故B错;C.对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性![]() ,电离常数
,电离常数![]() ,所以C选项是正确的;D.NaX电离后不水解,X-的物质的量浓度
,所以C选项是正确的;D.NaX电离后不水解,X-的物质的量浓度![]() ,NaY、NaZ电离后都部分水解,根据物料守恒可以知道:
,NaY、NaZ电离后都部分水解,根据物料守恒可以知道:![]() ;
;![]() ,所以
,所以![]() ,所以D选项是正确的;
,所以D选项是正确的;
所以D选项是正确的.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某碳酸钠样品中含有少量氯化钠杂质,为测定该样品中碳酸钠的质量分数,进行了如下实验:

请回答下列问题:
(1)操作A用到的玻璃仪器除烧杯外还必需有_______________、_______________;
(2)在实验过程中加入饱和石灰水后发生反应的离子方程式是_____________________。
(3)为探究上述反应后滤液中的溶质成分,甲同学向滤液中滴加过量稀盐酸,发现无气泡产生,说明滤液中一定不含 _________________(填溶质的化学式,下同),若有气泡产生,那么测定的样品中碳酸钠的质量分数___________(填偏大、偏小、无影响)。
(4)在(3)探究中,滴加盐酸前滤液中的溶质除氯化钠外,一定还含有的溶质是________;滴加盐酸的过程中一定发生反应的离子方程式为 ___________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如右图所示,则:
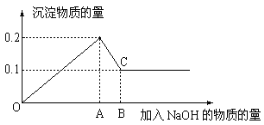
(1)图中C点表示当加入________mol NaOH时,Al3+已完全转化为____________(填微粒符号)
(2)图中线段OA和AB两段NaOH的物质的量之比为 ____________。
(3)写出AB段发生反应的离子方程式___________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知常温下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.01mol/L的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示。下列说法错误的是

A. n=7
B. 水的电离程度先增大再减小
C. 常温下,0.01mol/L的氨水溶液中NH3·H2O的电离度为3.98%
D. Y点溶液中c(NH3·H2O)+(OH-)=c(CH3COO-)+c(H+)
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知NO和O2转化为NO2的反应机理如下:
①2NO(g)
 2N2O2(g)(快) △H1<0 平衡常数K1
2N2O2(g)(快) △H1<0 平衡常数K1②N2O2(g) +O2(g)
 2NO2(g) (慢) △H2<0 平衡常数K2
2NO2(g) (慢) △H2<0 平衡常数K2下列说法正确的是
A. 反应过程中的能量变化可用图a表示

B. 2NO(g) +O2(g)
 2NO2(g)的△H=-(△H1+△H2)
2NO2(g)的△H=-(△H1+△H2)C. 2NO(g)+O2(g)
 2NO2(g)的平衡常数K=K1/K2
2NO2(g)的平衡常数K=K1/K2D. 反应②的速率大小决定2NO(g)+O2(g)
 2NO2(g)的反应速率
2NO2(g)的反应速率 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列互为同分异构体的是
A. 红磷和白磷 B. 16O和18O C. 甲烷和丁烷 D. CH3OCH3和CH3CH2OH
相关试题

