
【题目】黄铜矿(主要成分为二硫化亚铁铜:CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼铜的反应为8CuFeS2+21O2 ![]() 8Cu+4FeO+2Fe2O3+16SO2 。
8Cu+4FeO+2Fe2O3+16SO2 。
(1)若CuFeS2中Fe的化合价为+2,反应中被还原的元素是__________(填元素符号)。
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在Fe3+的方法是_________(注明试剂、现象、结论)。
(3)上述冶炼过程产生大量SO2。下列处理方案中合理的是_____________(填代号)
a 高空排放 b 用于制备硫酸 c 用纯碱溶液吸收制Na2SO3 d 用浓硫酸吸收
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是________________。
(5)实验室制备,收集干燥的SO2,所需仪器如下。
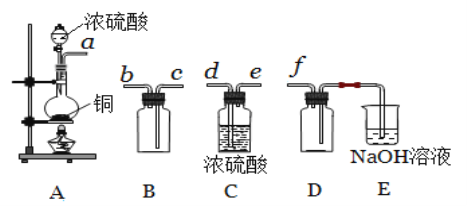
①其中装置A产生SO2 ,反应的化学方程式为_______________。
②请按气流方向连接各仪器接口,顺序为a →_____→_______→________→ _______→ f ,装置E中NaOH溶液的作用是____________。
【答案】Cu、O 取少量溶液,滴加KSCN溶液,溶液变红 bc 将气体通入品红溶液中,如果品红溶液褪色,加热后又变红,则证明有SO2 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O d e c b 吸收多余的SO2,防止污染空气
CuSO4+SO2↑+2H2O d e c b 吸收多余的SO2,防止污染空气
【解析】
(1)8CuFeS2+21O2 ![]() 8Cu+4FeO+2Fe2O3+16SO2中,Cu元素的化合价由+2价降低为0、O元素的化合价由0降低为-2价,Fe元素的化合价由+2价升高为+3价、S元素的化合价由-2价升高为+4价;
8Cu+4FeO+2Fe2O3+16SO2中,Cu元素的化合价由+2价降低为0、O元素的化合价由0降低为-2价,Fe元素的化合价由+2价升高为+3价、S元素的化合价由-2价升高为+4价;
(2)铁离子遇KSCN溶液为血红色;
(3)二氧化硫为环境污染物,不能排放,可用于制备硫酸或亚硫酸盐;
(4)二氧化硫具有漂白性,且漂白具有暂时性;
(5)实验室制备,收集干燥的SO2,由装置可知,A为反应装置,C为干燥装置,B为收集装置,D为防止倒吸,E为尾气处理,以此来解答。
(1)8CuFeS2+21O2 ![]() 8Cu+4FeO+2Fe2O3+16SO2中,Cu元素的化合价由+2价降低为0、O元素的化合价由0降低为-2价,反应中被还原的元素是Cu、O;
8Cu+4FeO+2Fe2O3+16SO2中,Cu元素的化合价由+2价降低为0、O元素的化合价由0降低为-2价,反应中被还原的元素是Cu、O;
(2)用稀H2SO4浸泡上述反应制取铜后剩余的固体残渣,取少量所得溶液,检验溶液中存在Fe3+的方法是取少量溶液,滴加KSCN溶液,溶液变红;
(3)二氧化硫为环境污染物,不能高空排放,与浓硫酸不反应,可用于制备硫酸或亚硫酸盐,只有bc符合;
(4)验证黄铜矿冶炼铜的反应后气体中含有SO2的方法是将气体通入品红溶液中,如果品红溶液褪色,加热后又变红,则证明有SO2;
(5)①装置A产生SO2,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
②由装置可知,A为反应装置,C为干燥装置,B为收集装置,D为防止倒吸,E为尾气处理,则按气流方向连接各仪器接口,顺序为a→d→e→c→f,装置D的作用是 安全瓶,防止倒吸;装置E中NaOH溶液的作用是吸收多余的SO2,防止污染空气。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图有机物的正确命名为 ( )

A.2-乙基-3,3-二甲基戊烷B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷D.3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛分子结构式如图,用2个Cl取代甲醛中的H可得到碳酰氯,下列描述正确的是( )
![]()
A.甲醛分子和碳酰氯分子是等电子体
B.碳酰氯分子中的C原子为手性碳原子
C.甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D.碳酰氯分子为平面三角形,分子中存在有3个σ键、1个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液加热反应可制取氯气,他们设计如下实验用于制取氯气并验证其性质。

试回答:
(1)该实验中A部分的装置是___________ (填写字母)。A部分的装置中发生反应的化学方程式为:___________。

(2)B中的发生反应的离子方程式为____________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因:___________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)__________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。忽略温度变化的影响,下列说法错误的是

A.阳极反应为![]()
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):

已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
![]()
回答下列问题:
(1)装置A中a的作用是______________;装置C中的试剂为________________;装置A中制备Cl2的化学方程为______________。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是________________。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入___________(填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为______________(填标号)。
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含![]() 的质量分数表达式为_________________。
的质量分数表达式为_________________。
下列关于样品组成分析的说法,正确的是__________(填标号)。
A.![]() 时,样品中一定不含杂质
时,样品中一定不含杂质
B.![]() 越大,样品中
越大,样品中![]() 含量一定越高
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2、NH3、O2混合气22.4L通过稀硫酸后,溶液质量增加了26.7g,气体体积缩小为4.48L。(气体体积均在标况下测定)剩余气体能使带火星的木条着火,则混合气体的平均相对分子质量为(4NO2+O2+2H2O=4HNO3)
A.28.1B.30.2C.33.1D.34.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红热的炭与浓硫酸可发生反应。
(1)写出该化学反应方程式;并用“双线桥”标出该反应中电子的转移的方向和数目___。
(2)现欲设计一个实验以验证此反应所生成的各种产物。实验中可供使用的试剂有:浓硫酸、稀硫酸、澄清石灰水、NaOH溶液、品红溶液、酸性高锰酸钾溶液、无水硫酸铜固体和碱石灰。有一个同学按气体的流动方向设计了一个实验过程,其所使用的试剂次序可表示为:气体产物→试剂Ⅰ→试剂Ⅱ→试剂Ⅲ→试剂Ⅱ→试剂Ⅳ
①试剂Ⅰ、Ⅱ、Ⅲ、Ⅳ分别为___,___,___,___;
②说出试剂Ⅱ使用两次的作用分别是___,___;
③写出气体产物通过试剂Ⅳ时的离子方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com