【题目】第四周期有18种元素,其相关化合物在化工、医药、材料等领域均有着广泛的应用。请回答下列问题:
(1)基态钙原子核外电子云形状为____________,电子占据的最高能层符号是____________。
(2)五氧化二钒(V2O5)是硫酸工业中重要的催化剂,基态钒原子的价电子排布式为____________。
(3)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,1molCN-中含π键的数目为____________,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是____________。
(4)镓、锗、砷、硒的第一电离能由大到小的顺序为____________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维渗杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为____________,中心原子的杂化类型为____________;砷酸酸性弱于硒酸,从分子结构的角度解释原因____________;砷化硼是一种新型材料,或成为最好的热导体,其结构与金刚石相似,已知砷化硼晶胞参数为bpm,则该晶体的密度为____________ g ·cm-3。(NA表示阿伏加德罗常数的值)。
【答案】 球形和哑铃形 N 3d3 4s2 2NA Fe3+的3d5半满状态更稳定 As>Se>Ge>Ga 分子晶体 sp3 硒酸中非羟基氧原子较多(或其他合理解释) 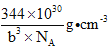
【解析】(1)基态钙原子核外电子排布式为1s22s22p63s23p64s2,由于s、p两个能级的电子云形状分别为球形和哑铃形,所以基态钙原子核外电子云形状为球形和哑铃形;电子占据的最高能层是第四层,符号是N;
(2)钒的原子序数为23,所以其基态的价电子排布式为3d3 4s2;
(3)在CN-内部有一个σ,两个π键,所以1molCN-中含π键的数目为2NA;Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,3d5是半充满状态,比较稳定,所以Fe2+易被氧化成Fe3+;
(4)同周期主族元素的第一电离能从左到右是依次增大的,但其中ⅡA和ⅢA,以及ⅤA和ⅥA之间存在有全满和半满的情况,所以有反常现象,因此镓、锗、砷、硒的第一电离能由大到小的顺序为As>Se>Ge>Ga;四氯化锗的熔沸点都很低,所以其晶体为分子晶体;中心原子即Ge的杂化类型为sp3,可以和四个氯原子形成四个等价的共价键;砷酸的分子式为H3AsO4,而硒酸的分子式为H2SeO4,所以在分子结构上,砷酸分子中的非羟基氧原子数少于硒酸的,所以砷酸酸性弱于硒酸;根据金刚石的晶胞结构可知,每个砷化硼晶胞中含有4个BAs分子,所以每个晶胞的质量m= ![]() ,其体积为V=(b×10-10)3 cm3,所以该晶体的密度为
,其体积为V=(b×10-10)3 cm3,所以该晶体的密度为![]()

