【题目】海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
(1)氯原子的结构示意图_____;工业上利用电解饱和食盐水来获得氯气,其化学方程式为_____。
(2)将氯气通入石灰乳中可制取漂白粉,化学方程式为_____。漂白粉溶于水后,和空气中的二氧化碳作用,所得的溶液可用于漂白这是利用生成的 HClO,而该溶液长时间放置又会失去漂白能力,所涉及的化学反应方程式为_____。
(3)向盛有 KI 溶液的试管中加入少许 CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4 层会逐渐变浅,最后变成无色。
完成下列填空:
(a)写出并配平 CCl4层由紫色变成无色的化学反应方程式,并用“单线桥”标出电子转移的方向和数目。_____________
_____+_____+_____→_____HIO3+_____该反应中,_____元素的化合价升高。
(b)把 KI 换成 KBr,则 CCl4层变为_____色,继续滴加氯水,CCl4 层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_____。
(c)加碘盐中含碘量为 20mg~50mg/kg。制取加碘盐(含 KIO3 的食盐)1000kg,若 KI 与 Cl2 反应之 KIO3,至少需要消耗 Cl2_____mol(保留 2 位小数)。
【答案】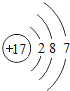 2NaCl+2H2O
2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH 2Ca(
Cl2↑+H2↑+2NaOH 2Ca(
OH)
2+2Cl2=Ca(
ClO)2+CaCl2+2H2O Ca(
ClO)
2+CO2+H2O=CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑
2HCl+O2↑ ![]() 5Cl2 I2 6H2O 2 10HCl I 红棕 HBrO3>Cl2>HIO3 0.47
5Cl2 I2 6H2O 2 10HCl I 红棕 HBrO3>Cl2>HIO3 0.47
【解析】
(1)氯原子的核外电子数为17,最外层为7个电子,其正确的原子结构示意图为 ;工业上利用电解饱和食盐水来获得氯气,其化学方程式为2NaCl+2H2O
;工业上利用电解饱和食盐水来获得氯气,其化学方程式为2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
故答案为: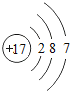 ;2NaCl+2H2O
;2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
(2)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式:2Ca(
OH)
2+2Cl2=Ca(
ClO)2+CaCl2+2H2O,次氯酸酸性比碳酸弱,Ca(ClO)2与空气中的CO2反应生成HClO和CaCO3沉淀,反应的方程式为Ca(
ClO)
2+CO2+H2O=CaCO3↓+2HClO,产生有漂白、杀菌作用的次氯酸,该溶液可用于漂白这是利用了生成的HClO的氧化性;HClO见光易分解,会失去漂白能力,分解的方程式为:2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
故答案为:2Ca(
OH)
2+2Cl2=Ca(ClO)2+CaCl2+2H2O;Ca(
ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(3)a.氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,反应的方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,反应中I元素的化合价升高,用“单线桥”标出电子转移的方向和数目为![]() ;
;
故答案为:![]() ;5Cl2、I2、6H2O、2、10HCl;I;
;5Cl2、I2、6H2O、2、10HCl;I;
b.KI换成KBr时,得到的是溴单质,则其在CCl4中呈红棕色;继续滴加氯水时,颜色不变,可知氯水不能将溴单质氧化成HBrO3故其氧化性强弱顺序为:HBrO3>Cl2>HIO3,
故答案为:红棕;HBrO3>Cl2>HIO3;
c.1000kg加碘食盐中含碘20g,KI+3Cl2+3H2O=KIO3+6HCl,根据KIO3~I~KI~3Cl2可知,则需要消耗Cl2的物质的量=![]() ×3=0.47mol;
×3=0.47mol;
故答案为:0.47。

