【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g) ![]() 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A. 生成C的速率与A的消耗的速率相等
B. A、B、C的浓度相等
C. 单位时间生成n mol A,同时生成 2n mol C
D. A、B、C的分子数之比为 1∶3∶2
参考答案:
【答案】C
【解析】A、生成C的速率与A的消耗的速率相等,都表示正反应速率,不能说明达到了平衡状态,故A错误;B、各组分的浓度相等,不能证明各组分的浓度不变,无法判断是否达到了平衡状态,故B错误;C、单位时间生成n mol A,同时生成 2n mol C,表示正逆反应速率相等,说明达到平衡状态,故C正确;D、各组分的分子数之比,无法判断各组分的浓度是否变化,无法判断是否达到平衡状态,故D错误;故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】高铁电池能长时间保持稳定的放电电压,有广泛的应用前景。总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述错误的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述错误的是A. 充电时,Zn板应与外接电源的负极相连
B. 放电时,溶液中的OH-从正极向负极移动
C. 正极反应式为:FeO42-+3e-+4H2O= Fe(OH)3+5OH-
D. 充电时,当转移0.2mol电子时,阴极质量增加3.4g
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________。
(2)Ti能与B、C、N、O等非金属元素形成稳定的化合物,B、C、N的电负性由大到小的顺序为_____;C、N、O的第一电离能由大到小的顺序为_____________。
(3)N的氢化物常作制冷剂,原因是______________。
(4)月球岩石—玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。
SO42-的空间构型为_______形。其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:______。
(5)Ti、Ca、O相互作用能形成如图晶体结构(Ti4+位于立方体的顶点、Ca2+位于立方体体心),该晶体的化学式为________。Ti4+和周围_____个O2-相紧邻。该晶胞的边长为apm,则其密度为______g/cm3。
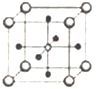
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取的乙炔气体中常混有少量H2S、CO2和水蒸气,为了得到干燥纯净的乙炔气体,选择最简便的实验方案有( )
A.通过NaOH后,通过浓H2SO4,再通过石灰水
B.通过CuSO4溶液后再通过石灰水
C.通过五氧化磷,再通过无水CaCl2
D.通过足量的碱石灰
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关除杂方法正确的是
A. 除去Fe3+中Al3+:加入过量氨水充分反应后,过滤
B. 除去FeCl3中少量CuCl2:加入足量铁粉,过滤
C. 除去NaHCO3溶液中的Na2CO3:通入过量CO2充分反应
D. 除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤
-
科目: 来源: 题型:
查看答案和解析>>【题目】X、Y、Z、R、W是原子序数递增的五种短周期主族元素,周期数之和为11,其中Y元素最高化合价与最低化合价代数和为2, Z和R可形成R2Z和R2Z2型化合物,R是五种元素中原子半径最大的,Z和W是同族元素,下列说法错误的是
A. 简单离子半径人小顺序为:W>Z>R
B. X2Z2的电子式为:

C. X2Z的沸点比X2W的沸点高
D. Y元素最高价氧化物的水化物浓溶液可以用铝制容器盛装
-
科目: 来源: 题型:
查看答案和解析>>【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
相关试题

