【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,能使有毒气体转化为无毒气体:4CO(g)+2N02(g)![]() C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C. 2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
浓度/mol·L-1 | ||||||
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析Tl℃时,该反应在0~20 min的平均反应速率v(C02)=___;计算该反应的平衡常数K=____。(保留两位有效数字)
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)_____。
(3)以CO2span>与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____。
(4)科学家利用原电池原理,在酸性溶液中将N02转化为HN03,则该转化的负极电极方程式为____。
参考答案:
【答案】A B 0.015 mol·L-1·min-10.56通入一定量NO(或适当缩小容器体积或充入一定量1∶1的氮气和二氧化碳)2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ΔH=–87.0 kJ·mol-1NO2-e-+H2O=NO3-+2H+
【解析】
(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则
A.容器内混合气体颜色不再变化说明NO2浓度不再发生变化,反应达到平衡状态,A正确;
B.正反应体积减小,则容器内的压强保持不变,说明反应达到平衡状态,B正确;
C. 2v逆(NO2)=v正(N2)时不满足反应速率之比是化学计量数之比,没有达到平衡状态,C错误;
D.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,容器内混合气体密度保持不变不能说明反应达到平衡状态,D错误。
答案选AB。
(2)①0~20min内,CO2的平均反应速率v(CO2)=0.3mol/L÷20min=0.015molL-1min-1;反应C(s)+2NO(g)![]() N2(g)+CO2(g)的平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,因此反应的平衡常数K=c(N2)×c(CO2)/c2(NO)=0.3×0.3/0.42=0.56;
N2(g)+CO2(g)的平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,因此反应的平衡常数K=c(N2)×c(CO2)/c2(NO)=0.3×0.3/0.42=0.56;
②30min后,只改变某一条件,反应重新达到平衡,依据图表数据分析,平衡状态物质浓度增大,依据平衡常数计算K=c(N2)×c(CO2)/c2(NO)=0.36×0.36/0.482=0.56,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以改变的条件可能是通入一定量NO或适当缩小容器体积或充入一定量1∶1的氮气和二氧化碳;
(3)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ΔH=–87.0 kJ·mol-1;
(4)利用原电池原理,在酸性溶液中将N02转化为HN03,负极发生失去电子的氧化反应,则该转化的负极电极方程式为NO2-e-+H2O=NO3-+2H+。
-
科目: 来源: 题型:
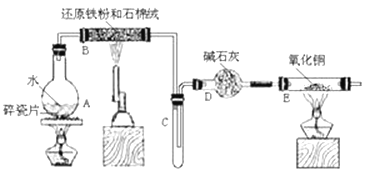
查看答案和解析>>【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验。(图中夹持及尾气处理装置均已略去)
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_________________________________。
装置B中发生反应的化学方程式是___________________________________。
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行________________________, 装置E中的现象是_____________________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为________。
(2)EAB2D4水溶液显酸性的原因是________。
(3)将等浓度等体积的EABD3溶液和E2BD3溶液混合,所得混合溶液中各离子的离子浓度由大到小的顺序为____。
(4)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2溶液反应的离子方程式______。
(5)常温下,测得X和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是____。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2(g)
 2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5mol、A2:0.2mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将____移动(填“正向”、“逆向”或“不”)。
2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5mol、A2:0.2mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将____移动(填“正向”、“逆向”或“不”)。 -
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。甲组同学采用如右图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4 g铜。

(1)仪器a的名称是_______。
(2)在铜与硝酸的反应中,硝酸所表现出的化学性质主要有_______。
(3)仪器c中收集的气体主要是_______。(填分子式)
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、
②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1 硝酸银溶液中,
其中Ag+浓度最小的是____________。(填序号)
(2)电解氯化钠可以得到多种化工原料。用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO
 等杂质。某次除杂操作时,往粗盐水中先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。某次除杂操作时,往粗盐水中先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。
,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。 -
科目: 来源: 题型:
查看答案和解析>>【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D、E为无色气体,C能使湿润的红色石蕊试纸变蓝,B常温下为无色液体,Fe遇浓的G溶液钝化。

(1)写出下列各物质的化学式:
B:____________;F:____________;G:___________。
(2)写出下列变化的反应方程式:
A→D:________________________________________;
G→E:________________________________________。
(3)实验室里,常用加热_____________________的混合物的方法制取气体C,常采用____________法来收集。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
相关试题

