
【题目】配位键是一种特殊的化学键,其中共用电子对由某原子单方面提供。如![]() 就是由
就是由![]() (氮原子提供共用电子对)和
(氮原子提供共用电子对)和![]() (缺电子)通过配位键形成的。据此回答下列问题。
(缺电子)通过配位键形成的。据此回答下列问题。
(1)下列粒子中存在配位键的是__________(填序号)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)硼酸(![]() )溶液呈酸性,试写出其电离方程式:____________________。
)溶液呈酸性,试写出其电离方程式:____________________。
(3)科学家对![]() 结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
甲: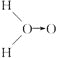 (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
乙:HOOH
化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:____________。
【答案】BD ![]()
![]() +H2→C2H5OC2H5+H2O 用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)
+H2→C2H5OC2H5+H2O 用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)
【解析】
(1)分析各物质是否有提供孤对电子的配体和能容纳电子的空轨道,进而作出判断;
(2)硼酸为缺电子分子,能接受孤对电子;
(3)根据题意,该实验设计的思路为:用C2H5OH与浓H2SO4反应生成的(C2H5)2SO4与H2O2反应生成A(C2H5)2O2,再用还原剂H2还原,检测是否生成水,如果生成水则H2O2为甲结构,否则为乙结构。
(1)根据配位键的概念可知,要形成配位键必须有提供孤对电子的配体和能容纳孤对电子的空轨道。
A. CO2中的碳氧键为C和O提供等量电子形成,没有配位键;
B. H3O+可看作是H2O中的O提供孤对电子与H+共用形成,所以有配位键;
C. CH4中C-H键为C和H提供等量电子形成,没有配位键;
D. H2SO4中S和非羟基O之间有配位键;
答案为:BD;
(2)硼酸中B原子含有空轨道,水中的氧原子提供孤对电子,形成配位键,所以硼酸溶于水显酸性,电离方程式为H3BO3+H2O![]() H++[B(OH)4]-。
H++[B(OH)4]-。
答案为:H3BO3+H2O![]() H++[B(OH)4]-;
H++[B(OH)4]-;
(3)根据原子守恒可知,A的分子式为C4H10O2,所以如果双氧水的结构如甲所示,O→O键遇到还原剂时易断裂,则c中的反应为![]() +H2→C2H5OC2H5+H2O;如果双氧水的结构如乙所示,则反应为C2H5O-OC2H5 + H2 → 2CH3OH,两者的区别之一为是否有水生成,所以可利用无水硫酸铜检验,从而作出判断。
+H2→C2H5OC2H5+H2O;如果双氧水的结构如乙所示,则反应为C2H5O-OC2H5 + H2 → 2CH3OH,两者的区别之一为是否有水生成,所以可利用无水硫酸铜检验,从而作出判断。
答案为: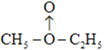 +H2→C2H5OC2H5+H2O;用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)。
+H2→C2H5OC2H5+H2O;用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了在锂离子电池领域 作出贡献的三位科学家。他们于 1972年提出“摇椅式“电池 ( Rock ing chair battery), 1980年开发出 LiCoO2材料, 下图是该电池工作原理图,在充放电过程中, Li+在两极之间“摇来摇去”,该电池充电时的总反应为:LiCoO2+ 6C ( 石墨)=Li (1-x)CoO2+LixC6。下列有关说法正确的是
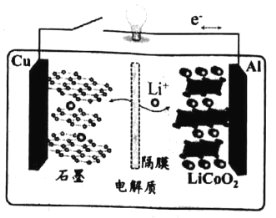
A.充电时,Cu 电极为阳极
B.充电时,Li+将嵌入石墨电极
C.放电时,Al 电极发生氧化反应
D.放电时,负极反应 LiCoO 2—xe-=Li (1-x)CoO2+ (1-x ) + xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)![]() S2Cl2(g) △H1=xkJ/mol
S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)![]() 2SCl2(g) △H2=ykJ/mol
2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键 | S-S | S-Cl | Cl-Cl |
键能/kJ/mol | a | b | c |
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为: ![]()
C. y=2b-a-c D. 在S2(1)+2Cl2(g)![]() 2SCl2(g)的反应中,△H=(x+y)kJ/mol
2SCl2(g)的反应中,△H=(x+y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①存在阳离子的物质中一定存在阴离子
②金属元素原子和非金属元素原子之间一定形成离子键
③离子键的实质是阳离子、阴离子间的相互吸引
④根据电离方程式![]() ,可判断HCl分子中存在离子键
,可判断HCl分子中存在离子键
⑤某些离子化合物中含有共价键
A.仅①②⑤B.仅③C.仅③④D.仅⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 分子中三种原子均以杂化轨道成键
分子中三种原子均以杂化轨道成键
B.![]() 的电子式为
的电子式为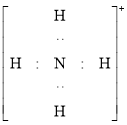 ,该离子呈平面正方形
,该离子呈平面正方形
C.![]() 分子中的4个
分子中的4个![]() 键都是由氢原子的
键都是由氢原子的![]() 轨道与碳原子的
轨道与碳原子的![]() 轨道重叠形成的
轨道重叠形成的
D.![]() 分子中碳原子的
分子中碳原子的![]() 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的![]() 轨道重叠,形成4个
轨道重叠,形成4个![]() 键
键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol某有机物在稀硫酸作用下,水解生成2 mol相同的物质。有下列物质:
①蔗糖 ②麦芽糖 ③淀粉 ④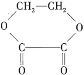 ⑤
⑤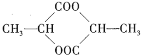
⑥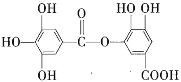 ⑦
⑦![]()
其中符合此题目要求的是( )
A.②⑤⑥⑦B.②④⑤⑦C.①②⑤⑦D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种![]() 工程树脂由丙烯腈(
工程树脂由丙烯腈(![]() ,用
,用![]() 表示)、1,
表示)、1,![]() 丁二烯(
丁二烯(![]() ,用
,用![]() 表示)和苯乙烯(
表示)和苯乙烯(![]() ,用
,用![]() 表示)按一定比例共聚而得。
表示)按一定比例共聚而得。
(1)![]() 和
和![]() 三种单体中,
三种单体中,![]() 原子个数比的比值最小的单体是___________(填物质名称)。
原子个数比的比值最小的单体是___________(填物质名称)。
(2)经元素分析可知,该![]() 工程树脂的组成为
工程树脂的组成为![]() (
(![]() 为正整数),则原料中
为正整数),则原料中![]() 和
和![]() 的物质的量之比是____________(用
的物质的量之比是____________(用![]() 表示)。
表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备乙炔,并验证乙炔的某些化学性质,已知制备的乙炔气体中往往含有少量的![]() 气体。请回答下列问题:
气体。请回答下列问题:

(1)实验室制备乙炔的化学方程式为________;为了使产生乙炔的气流平稳,装置![]() 的分液漏斗中常用______________代替水。
的分液漏斗中常用______________代替水。
(2)装置![]() 中
中![]() 溶液的作用是________,发生反应的离子方程式为_________。
溶液的作用是________,发生反应的离子方程式为_________。
(3)装置![]() 中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
(4)装置![]() 中观察到的现象是________。
中观察到的现象是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com