
【题目】资源回收利用意义重大,镀锌废铁屑(表面附有锌皮、少量铁锈及油污)有很多用途,某工厂综合利用镀锌废铁屑的工艺如下图。请回答:

(1)用氢氧化钠溶液浸泡废铁屑的目的是_________。
(2)下列物质中最适合充当氧化剂A的是_______(填标号)。
A. KMnO4 B. Cl2 C.H2O2 D. HNO3
(3)聚合硫酸铁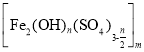 是水处理中重要的絮凝剂,聚合釜中主要发生“水解”和“聚合”两个过程,“水解”时反应的化学方程式为__。聚合釜中溶液的pH必须控制在一定的范围内,pH偏小Fe3+水解程度弱,pH偏大则__;相对于常压蒸发,减压蒸发的优点是__。
是水处理中重要的絮凝剂,聚合釜中主要发生“水解”和“聚合”两个过程,“水解”时反应的化学方程式为__。聚合釜中溶液的pH必须控制在一定的范围内,pH偏小Fe3+水解程度弱,pH偏大则__;相对于常压蒸发,减压蒸发的优点是__。
(4)纳米Fe3O4,可用于改善石墨烯材料的性能。制得溶液B时加入的氧化剂A需适量,原因是_____。
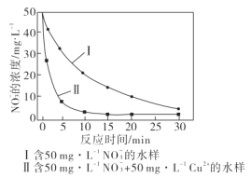
(5)废铁屑也能用来生产纳米铁粉,纳米铁粉能够去除地下水中的NO3-,反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是__。相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见下图),产生该差异的可能原因是___。
【答案】除去铁屑表面的油污、溶解锌皮 C Fe2(SO4)3+nH2O![]() +
+![]() H2SO4 形成氢氧化铁沉淀 降低蒸发温度防止产物分解 使溶液B中的Fe2+和Fe3+保持一定比例 纳米铁粉与H+反应生成H2 Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)
H2SO4 形成氢氧化铁沉淀 降低蒸发温度防止产物分解 使溶液B中的Fe2+和Fe3+保持一定比例 纳米铁粉与H+反应生成H2 Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)
【解析】
分析流程图,废铁屑粉碎、过筛后用NaOH进行碱浸,其中废铁屑表面的油污在碱性条件下水解,锌的化学性质和铝相似,也能和NaOH反应,故锌皮溶解。过滤后得到的溶液中主要成分为偏锌酸钠,调节溶液pH值,生成Zn(OH)2沉淀,经一系列变化,最终得到ZnO。
过滤所得的不溶物中包括铁屑、铁锈等物质,用硫酸进行酸浸,可得到FeSO4和Fe2(SO4)3的混合溶液。将混合溶液分为2份,一份加入过量的氧化剂,在反应釜中将Fe2+完全氧化为Fe3+。再在聚合釜中加入水和硫酸,然后进行减压蒸发得到聚合硫酸铁。另一份中加入适量氧化剂,将溶液中部分Fe2+氧化为Fe3+,调节溶液pH,由题可知,溶液B中含Fe2+、Fe3+。向溶液B中加入NaOH,然后通入N2,加热条件下,得到纳米Fe3O4。据此分析。
(1)废铁屑表面附有锌皮、少量铁锈及油污,油污在碱性条件下水解,锌可以与NaOH反应,故用NaOH溶液浸泡可除去废铁屑表面的油污、溶解锌皮,答案为:除去铁屑表面的油污、溶解锌皮;
(2)由流程可知,氧化剂A氧化后没有引入新的杂质,则只有H2O2作氧化剂符合条件,答案为:C;
(3)根据Fe3+的水解,可得水解反应方程式为:Fe2(SO4)3+nH2O![]() +
+![]() H2SO4;若pH偏大,则发生反应:Fe3++3OH-=Fe(OH)3↓,生成Fe(OH)3沉淀。相对于常压蒸发,减压蒸发时可降低物质的沸点,从而降低蒸发温度,能防止或减少热敏物质的分解。答案为:Fe2(SO4)3+nH2O
H2SO4;若pH偏大,则发生反应:Fe3++3OH-=Fe(OH)3↓,生成Fe(OH)3沉淀。相对于常压蒸发,减压蒸发时可降低物质的沸点,从而降低蒸发温度,能防止或减少热敏物质的分解。答案为:Fe2(SO4)3+nH2O![]() +
+![]() H2SO4;形成氢氧化铁沉淀;降低蒸发温度防止产物分解;
H2SO4;形成氢氧化铁沉淀;降低蒸发温度防止产物分解;
(4)Fe3O4中Fe2+和Fe3+的比约为1:2,加适量氧化剂A,能使溶液B中的Fe2+和Fe3+保持一定比例;答案为:使溶液B中的Fe2+和Fe3+保持一定比例;
(5)pH偏低,则溶液中H+浓度较大,纳米铁粉会和H+反应生成H2,从而导致NO3-的去除率下降;分析题给浓度-时间图可知,含Cu2+的水样,其反应时间较短,在30min时,NO3-的浓度二者相等,则可知Cu或Cu2+在其中起催化作用,也可能是形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率;答案为:纳米铁粉与H+反应生成H2;Cu或Cu2+催化纳米铁粉去除NO3-的反应(或形成的Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)。


科目:高中化学 来源: 题型:
【题目】有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是
A. K+不一定存在 B. Ba2+、Mg2+不一定都存在
C. Cl-不一定存在 D. 混合溶液中CO32-的浓度为0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A. 反应需在300 ℃进行可推测该反应是吸热反应
B. 使用催化剂可提高反应速率
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL该溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到气体0.08mol;
③第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,回答下列问题:
(1)由第二份进行的实验得知混合物中应含有___________离子,其物质的量浓度为________。
(2)由第三份进行的实验可知12.54克沉淀的成分是______________(写沉淀化学式),其物质的量分别为______________________。
(3)原溶液中是否存在K+_______填“是”或“否)若存在则K+的浓度的取值范围是____________________(若不存在此空可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室用二氧化锰与浓盐酸制备氯气的实验装置,根据下图填空:
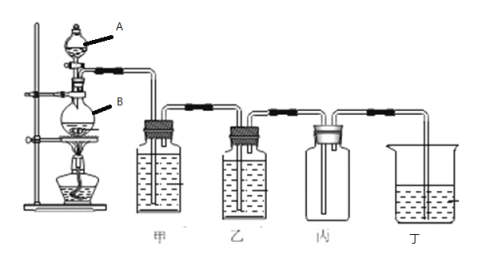
(1)仪器A的名称叫_______,仪器B的名称叫_______;
(2)写出用二氧化锰与浓盐酸制备氯气的离子方程式______;
(3)甲中盛有______,作用是_______;
(4)乙中盛有______,作用是_____;
(5)丙的作用是____,实验完成后丙中的现象是________;
(6)若丁中盛有NaOH溶液,写出发生反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是工业上制取纯硅的一种方法。

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有____(填反应代号);
(2)写出反应③的化学方程式____;
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1 373~1 623 K反应,生成化合物W,其化学方程式是____;
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是___(填化学式);分别通入W溶液中能得到白色沉淀的气体是___(填化学式);
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计的蔗糖水解反应如图所示(夹持装置省略)。下列说法错误的是( )
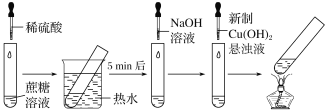
A.稀硫酸和热水浴都能加快蔗糖水解速率
B.滴加NaOH溶液的目的是调溶液的pH至碱性
C.加热至沸腾后试管内生成黑色沉淀
D.实验现象证明蔗糖水解有还原性物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且 HClO的杀菌能力比ClO- 强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO![]() H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO 和 ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是
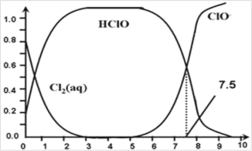
A.Cl2(g)+H2O![]() 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com