【题目】现有反应:
A.CaCO3![]() CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2![]() 2CO
2CO
D.2KOH+H2SO4=K2SO4+2H2O
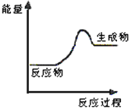
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是_______(填反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是__________(填反应序号),根据该原电池回答下列问题:
①负极材料是______,负极发生______(填“氧化”或“还原”)反应;正极反应式为_____。
②当导线中有1 mol电子通过时,理论上发生的变化是 _______ (填序号)。
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3) 对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。
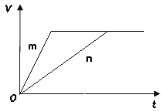
① m曲线表示锌与稀硫酸_________(填“X”或“Y”)反应。
② 锌分别与稀硫酸X、Y反应时,反应速率不同的原因是________(填序号)。
a. CuSO4作催化剂
b.加入硫酸铜溶液增大了c(![]() )
)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应2H2 + O2=2H2O设制一个化学电池(材料均用碳棒),回答下列问题:
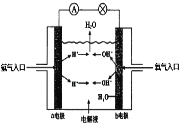
该电池的a极是______,(填正极或负极),若电解质溶液是稀硫酸,则![]() 移向______极,(填a或b),写出b极上的电极反应式________________.
移向______极,(填a或b),写出b极上的电极反应式________________.
【答案】C B Zn或锌 氧化 2H++2e-=H2↑ bc X c 负极 a O2+4e-+4 H+=2H2O
【解析】
(2)一般放热的氧化还原反应可以设计成原电池;
(3)加有少量硫酸铜的溶液中Zn会置换出铜单质,从而形成原电池加快反应速率;
(4)原电池的负极上发生失电子的氧化反应,正极上发生得电子的还原反应,反应2H2+ O2=2H2O中氢气失电子被氧化,所以通入氢气的一极为负极,通入氧气的一极为正极。
(1)图示反应的反应物的总能量低于生成物的总能量,所以为吸热反应;
A.碳酸钙受热分解为吸热反应,但该反应中没有元素化合价发生变化,不是氧化还原反应,故A不符合题意;
B.金属与酸的置换反应为放热反应,故B不符合题意;
C.碳与二氧化碳的反应为吸热反应,且该过程有元素化合价发生变化,属于氧化还原反应,故C符合题意;
D.酸碱中和反应为放热反应,且该反应不是氧化还原反应,故D不符合题意;
答案选C。
(2)上述四个反应中,Zn+H2SO4=ZnSO4+H2↑为放热的氧化还原反应,可以设计成原电池;
①该反应中Zn被氧化,所以负极材料为Zn,原电池中负极失电子发生氧化反应;正极为氢离子得电子生成氢气的反应,电极反应式为2H++2e-=H2↑;
②电池的负极反应为Zn-2e-=Zn2+;正极反应为2H++2e-=H2↑,所以转移1mol电子时,生成0.5molZn2+和0.5molH2;
a.溶液增重的质量为0.5mol×65g/mol-0.5mol×2g/mol=31.5g,故a错误;
b.根据a可知溶液增重31.5g,故b正确;
c.析出氢气的质量为0.5mol×2g/mol=1g,故c正确;
d.未标明温度和压强,无法确定气体的体积,故d错误;
综上所述选bc;
(3)①曲线m表示的反应速率更快,滴有硫酸铜的稀硫酸中形成原电池,反应速率更快,所以曲线m代表X;
②根据分析可知Zn首先与Cu2+反应生成Cu,Cu与Zn、稀硫酸构成原电池加快反应速率,导致X比Y的反应速率快,所以选c;
(4)a电极通入氢气发生氧化反应,为负极;原电池中阴离子流向负极,所以硫酸根移向a极;b极上氧气得电子发生还原反应,电解质溶液为酸性溶液,所以生成水,电极反应式为O2+4e-+4 H+=2H2O。

