
【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为__;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将__(填“增大”、“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量_2.1mol(填“<”、“>”或“=”),简单说明原因:__。
(4)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆_v正(填“<”、“>”或“=”)
【答案】9.52% 增大 > 正反应放热,升温,平衡逆向移动,气体的物质的量增大 <
【解析】
设反应的氧气的物质的量为x,列三段式有

则有2-2x+1-x+2x=2.1,解得x=0.9mol,即平衡时体系中n(SO2)=0.2mol,n(O2)=0.1mol,n(SO3)=1.8mol。
(1)根据分析可知,反应进行到t1时,SO2的体积分数为![]() =9.52%;
=9.52%;
(2)该容器为恒压容器,充入一定量的氩气(Ar),体积增大,反应物的分压减小,所以平衡向体积增大的方向移动,即向逆反方向移动,所以SO2的物质的量增大;
(3)已知该反应的正方向为放热反应,所以升高温度平衡逆移,逆方向为气体物质的量增大的方向,所以新平衡混合物中气体的总物质的量>2.1mol;
(4)保持容器的体积不再变化再加入0.2molSO2、0.1molO2和1.8molSO3,各物质的浓度扩大为原来的二倍,相当于在原平衡的基础压缩体积加压,则平衡会正向移动,所以v逆<v正。


科目:高中化学 来源: 题型:
【题目】白头翁素具有显著的抗菌作用,其合成路线如图所示:
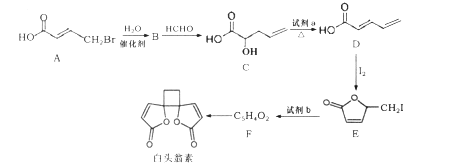
已知:
①RCH2Br![]() RCH=CHR’
RCH=CHR’
②2RCH=CHR’![]()
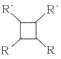
(以上R、R’代表氢、烷基)
(1)白头翁素的分子式为____。
(2)试剂a为______,E→F的反应类型为________。
(3)F的结构简式为_________。
(4)C中含有的官能团名称为________。
(5) A→B反应的化学方程式为_________。
(6)F与足量氢气加成得到G,G有多种同分异构体,其中属于链状羧酸类有____种。
(7)以乙烯为起始原料,选用必要的无机试剂合成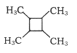 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖发酵可制得乳酸,从酸牛奶中也能提取出乳酸,纯净的乳酸为无色黏稠液体,易溶于水。为了研究乳酸的分子组成和结构,进行如下实验:
(1)称取乳酸![]() ,在某种状况下使其完全汽化,若相同状况下等体积氢气的质量为
,在某种状况下使其完全汽化,若相同状况下等体积氢气的质量为![]() ,则乳酸的相对分子质量为_______。
,则乳酸的相对分子质量为_______。
(2)若将上述乳酸蒸气在![]() 中燃烧只生成
中燃烧只生成![]() 和
和![]() ,当气体全部被碱石灰吸收后,碱石灰的质量增加
,当气体全部被碱石灰吸收后,碱石灰的质量增加![]() ;若将此气体通过足量的石灰水,产生
;若将此气体通过足量的石灰水,产生![]() 白色沉淀。则乳酸的分子式为________。
白色沉淀。则乳酸的分子式为________。
(3)乳酸分子能发生自身酯化反应,且其催化氧化产物不能发生银镜反应。若葡萄糖发酵只生成乳酸,试写出该反应的化学方程式:_______(忽略反应条件)。
(4)写出乳酸在催化剂作用下发生反应生成分子式为![]() 的环状酯的结构简式:__。
的环状酯的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用铂丝蘸取少量NaCl溶液进行焰色反应,火焰呈黄色 | 这是钠离子的发射光谱 |
C | NaI溶液 | 酸性条件下H2O2的氧化性比I2强 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种抗疟疾药物, 研究发现,该药在细胞水平上能有效抑制新型冠状病毒的感染。其合成路线如下:
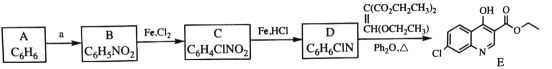

已知:

回答下列问题:
(1)A是一种芳香经, B 中官能团的名称为__________________。
(2)反应 A→B 中须加入的试剂a 为___________________。
(3)B 反应生成 C 的反应化学反应方程式是______________________。
(4)C→D 反应类型是_________, D的结构简式为_______________。
(5)F→G反应类型为________________。
(6)I是E的同分异构体,与E 具有相同的环状结构, 写出任意一种符合下列条件的I的结构简式是__________________________。
①I是三取代的环状有机物, 氯原子和羟基的取代位置与E相同;
②核磁共振氢谱显示I 除了环状结构上的氢外,还有4组峰, 峰面积比3:1:1:1;
③I加入NaHCO3溶液产生气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为__________________________。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:

序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是______对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是____________(用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究_________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下一系列反应,最终产物为草酸(乙二酸)。
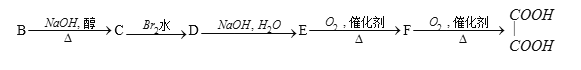
已知B为某一溴代物。
(1)推测用字母代表的化合物的结构简式:C____________ F ____________
(2)写出化学方程式:B→C_________________________E→F_______________
(3)E和草酸在一定条件下生成的环状化合物的结构简式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃是重要的工业原料,同时对环境造成严重影响,如破坏臭氧层等,请回答下列问题:
Ⅰ.氟利昂-12,即二氟二氯甲烷,分子式为![]() ,氟利昂-11,即一氟三氯甲烷,分子式为
,氟利昂-11,即一氟三氯甲烷,分子式为![]() 。氟利昂是破坏臭氧层的元凶,也是地球变暖的罪魁祸首,它所产生的温室效应是二氧化碳的数千倍。禁止使用氟利昂对保护地球环境具有极为重要的意义。破坏臭氧层的物质有制冷剂
。氟利昂是破坏臭氧层的元凶,也是地球变暖的罪魁祸首,它所产生的温室效应是二氧化碳的数千倍。禁止使用氟利昂对保护地球环境具有极为重要的意义。破坏臭氧层的物质有制冷剂![]() 等氟氯烃其破坏机理为
等氟氯烃其破坏机理为![]() 。
。
(1)活性氯(![]() )的作用是__________;
)的作用是__________;
(2)下列关于氟利昂![]() 、氟利昂
、氟利昂![]() 的推测不正确的有______________;
的推测不正确的有______________;
A 两种氟利昂在![]() 醇溶液中均可发生消去反应
醇溶液中均可发生消去反应
B 两种氟利昂均不存在同分异构体
C 直接用![]() 溶液均可检验两种氟利昂中的氯元素
溶液均可检验两种氟利昂中的氯元素
Ⅱ.已知二氯烯丹是一种除草剂,其合成路线如下:
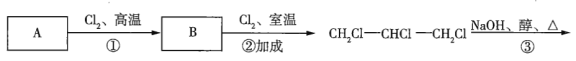
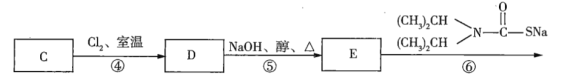
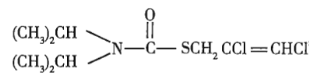 (二氯烯丹)
(二氯烯丹)
已知:D在反应⑤中所生成的E的结构只有一种。
(1)写出下列反应类型:反应①是___________,反应③是________,反应⑥是__________;
(2)写出下列物质的结构简式:A______,C______;
(3)写出反应③的化学反应方程式___________;
(4)写出有机物![]() 所有同分异构体的结构简式:________。
所有同分异构体的结构简式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com