【题目】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是元素周期表中原子半径最小的元素;Y元素基态原子有三个能级上有电子,且每个能级上的电子数相等;Z元素基态原子的单电子数在同周期元素基态原子中最多;W与Z同周期,第一电离能比Z的低;R与Y同主族;Q的最外层只有一个电子,其他电子层均有2n2个电子(n表示电子层序数)。请回答下列问题:
(1)Q的核外电子排布式为___。
(2)化合物X2W2中W的杂化方式为___;ZW2-的空间构型为___。
(3)Y、R的最高价氧化物中沸点较高的是___(填化学式),原因是___。
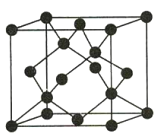
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图所示,该晶体的晶胞中所含Y原子的个数为___,Y原子的配位数为___,若晶胞的边长为apm,晶体的密度为ρg/cm3,则阿伏加德罗常数的值NA为___(用含a和ρ的代数式表示)。
【答案】1s22s22p63s23p63d10(或[Ar]3d10) sp3杂化 V形 SiO2 SiO2为原子晶体,CO2为分子晶体 8 4 ![]()
【解析】
X是元素周期表中原子半径最小的元素,则X为H元素;Y有三个能级上有电子,且每个能级上的电子数相等,则Y的核外电子排布式为1s22s22p2,故Y为C元素;R与Y同主族,结合原子序数大小顺序可知,R为Si元素;而Z元素基态原子的单电子数在同周期元素基态原子中最多,则Z的价电子排布式为ns2np3,且原子序数小于Si,则Z为N元素;W与Z同周期,第一电离能比Z的低则W为0元素;Q的最外层只有一个电子,其他电子层均有2n2个电子,不可能为短周期元素,原子序数小于30,故核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,则Q为Cu元素,以此分析。
根据以上分析可知X、Y、Z、W、R、Q分别是H、C、N、O、Si、Cu。
(1)Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,
故答案为:1s22s22p63s23p63d10(或[Ar]3d10);
(2)化合物H2O2的结构式为H—0—0—H,O原子价电子对数为4,故0原子采取sp3杂化;![]() 中N原子的孤电子对数为
中N原子的孤电子对数为![]() ,价电子对数为2+1=3,故其空间构型为V形,
,价电子对数为2+1=3,故其空间构型为V形,
故答案为:sp3杂化;V形;
(3)Y、R的最高价氧化物分别为CO2、SiO2,SiO2为原子晶体,CO2为分子晶体,故沸点较高的是SiO2,
故答案为:SiO2;SiO2为原子晶体,CO2为分子晶体;
(4)题图晶胞中所含C原子的个数为![]() ;每个C与周围的4个C原子相邻,故C原子的配位数为4;若晶胞的边长为apm,则晶胞的体积为(a×10-10)3cm3,晶体的密度为
;每个C与周围的4个C原子相邻,故C原子的配位数为4;若晶胞的边长为apm,则晶胞的体积为(a×10-10)3cm3,晶体的密度为![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,则
,则![]() ,故
,故![]() ,
,
故答案为:8;4;![]() 。
。

