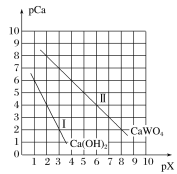
【题目】已知:TK时,Ca(OH)2、CaWO4都微溶于水。pCa=-lgc(Ca2+),pX=-lgc(WO42-)或-lgc(OH-)。TK时CaWO4、Ca(OH)2的沉淀溶解平衡曲线如图所示。
(1)①向Na2WO4溶液中加入饱和石灰水,现象为__,离子方程式为:__。
②Na2WO4溶液和石灰乳混合,会产生大量的CaWO4,则该反应的平衡常数K=__。
(2)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,钼酸钠晶体(Na2MoO4·2H2O)是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的![]() =__(结果保留2位有效数字)。
=__(结果保留2位有效数字)。
【答案】生成白色沉淀 Ca2++WO42-=CaWO4↓ 100 3.6×102
【解析】
由表中数据可知,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=1×10-8,显然,Ca(OH)2的溶解度比CaWO4大。根据溶度积的表达式进行相关计算和判断。
(1)①由于CaWO4的溶解度比Ca(OH)2小,向一定浓度的Na2WO4溶液中加入饱和石灰水,可以生成溶解度较小的CaWO4沉淀,现象为生成白色沉淀,离子方程式为:Ca2++WO42-=CaWO4↓。
②Na2WO4溶液和石灰乳混合,会产生大量的CaWO4,该过程发生沉淀的转化,离子方程式为Ca(OH)2+WO42- CaWO4+2OH-,则该反应的平衡常数K=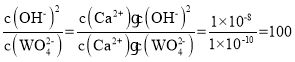 。
。
(2)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,BaSO4已沉淀完全,同理可推,溶液中的![]() =[Ksp(BaMoO4)]:[Ksp(BaSO4)]=(4.0×10-8):(1.1×10-10)=3.6×102。
=[Ksp(BaMoO4)]:[Ksp(BaSO4)]=(4.0×10-8):(1.1×10-10)=3.6×102。

