
【题目】近日,北京航空航天大学教授团队与中科院高能物理研究所合作,合成了Y、Sc(Y1/NC,Sc1/NC)单原子催化剂,用于常温常压下的电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法错误的是
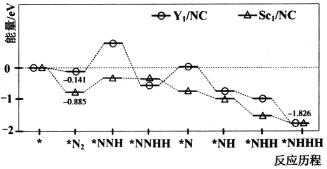
A.相同条件下,两种催化反应的焓变相同
B.实际生产中将催化剂的尺寸处理成纳米级颗粒可提高氨气的平衡转化率
C.使用Sc1/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为*N2+H→*NNH
D.升高温度一定可以提高氨气单位时间内的产率
【答案】BD
【解析】
A.根据盖斯定律,焓变只与反应物的总能量和生成物的总能量的相对大小,与反应途径无关,催化剂只改变反应历程,不改变反应的焓变,相同条件下,两种催化反应的焓变相同,A正确;
B.催化剂只能改变反应速率,不能影响化学平衡移动,故实际生产中将催化剂的尺寸处理成纳米级颗粒不能提高氨气的平衡转化率,B错误;
C.从图中可以看出,使用Sc1/NC单原子催化剂的反应历程中,最大能垒的反应过程可表示为*N2+H→*NNH,C正确;
D.从图中可知,合成氨的反应为放热反应,升高温度平衡逆向移动,且温度越高,催化剂吸附N2更困难,故升高温度虽然可以加快反应速率,但不一定可以提高氨气单位时间内的产率,D错误;
故答案为:BD。


科目:高中化学 来源: 题型:
【题目】已知反应: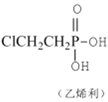 +4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。可用如图装置和给定的试剂制取1,2-二溴乙烷(其信息如下:相对分子质量为188、无色液体,密度2.18gcm-3,熔、沸点分别为9.79℃、131.4℃,不溶于水)。试管d中装有液溴(表面覆盖少量水)。回答下列问题:
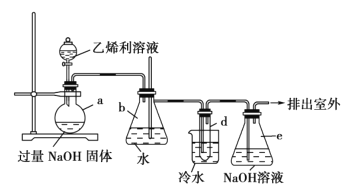
(1)仪器b的名称为______;其中长玻璃导管的作用是______。
(2)e装置的作用是______;其中所发生反应的离子方程式为______。
(3)试管d中发生反应的化学方程式为______。若用冰水代替烧杯中的冷水,可能引起的不安全后果是______。
(4)实验消耗40%乙烯利(摩尔质量为Mg·mol-1)溶液50g,制得产品mg,则乙烯利合成1,2-二溴乙烷的产率为______(用含M、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(主要成分是MnO2,含有Al2O3、SiO2等杂质),制备KMnO4的流程图如下:
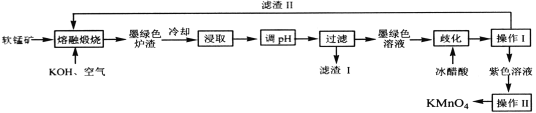
已知:K2MnO4固体和溶液均为墨绿色,溶液呈碱性,能发生可逆的歧化反应。
下列说法正确的是
A.向“浸取”后的溶液中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为Al(OH)3
B.“歧化”时,加入冰醋酸是为了调节溶液pH,使3MnO![]() +2H2O
+2H2O![]() 2MnO
2MnO![]() +MnO2+4OH-正向移动,促进KMnO4的生成,提高KMnO4的产率
+MnO2+4OH-正向移动,促进KMnO4的生成,提高KMnO4的产率
C.“歧化”步骤中调节溶液pH时,可以用浓盐酸来代替冰醋酸
D.“操作II”时,当有大量晶体析出时,利用余热蒸干,即得紫黑色KMnO4晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关合成氨工业的叙述,能够用勒·夏特列原理来解释的是
A.加入催化剂可以提高单位时间氨的产量
B.高压比常压条件更有利于合成氨的反应
C.500℃高温比室温更有利于合成氨的反应
D.N2和H2按物质的量之比1:2.8混合,更有利于氨的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
(1)硫酸铜溶液可以加快氢气生成速率的原因是____。
(2)25℃,该同学设计三个实验探究影响锌粉(足量)与稀硫酸反应速率的因素,有关数据如下表所示:
实验序号 | 体积/mL | ||
1.0mol·L-1硫酸溶液 | 饱和CuSO4溶液 | 水 | |
I | 30.0 | 1.0 | 9.0 |
II | 20.0 | 1.0 | Vx |
III | 30.0 | 3.0 | 7.0 |
①本实验待测数据可以是____。
②利用实验I和实验I来探究硫酸浓度对锌粉与稀硫酸反应速率的影响,Vx=__,理由是__。
③实验I和实验III的目的是__。
(3)用排水集气法收集实验I反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 60 | 140 | 252 | 420 | 510 | 540 |
①反应速率最大时间段是__min(填“0~1”、“1~2”、“2~3”、“3~4”、“4~5”或“5~6”下同),原因是____。
②反应速率最小时段是__min,原因是___。
③第2~3min时间段以稀硫酸的浓度表示的该反应速率(设溶液体积不变)是v(H2SO4)=___。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在稀硫酸中分别加入等体积的下列溶液,可行的是____(填字母)。
A.KNO3溶液 B.蒸馏水 C.Na2SO4溶液 D.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是应用广泛的有机高分子化合物,其中合成M的一种路线如下(部分反应条件略去):
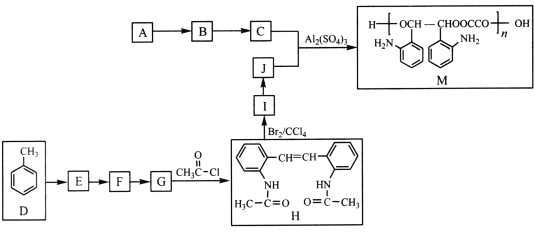
已知:①A的实验式为CH3O。
②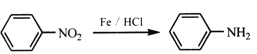 (-NH2容易被氧化)
(-NH2容易被氧化)
③![]()
④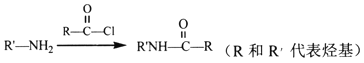
⑤![]()
回答下列问题:
(1)E的化学名称为_____________________________。
(2)H中官能团的名称为____________________________。
(3)D→E、I→J的转化过程中所用试剂和反应条件分别是_________、__________。
(4)C+J→M的化学方程式为_________________________________。
(5)同时满足下列条件的F的同分异构体有______种(不考虑立体异构)。
①含有的官能团与F相同;
②碳架结构与F完全相同;
③两个含氮官能团分别连在两个不同苯环上。
F的所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器为_______________(填序号)。
A.元素分析仪 B.红外光谱仪 C.质谱仪 D.核磁共振波谱仪
(6)参照上述合成路线和信息,以A和甲苯为有机原料(无机试剂任选),设计制备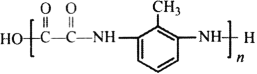 的合成路线。
的合成路线。
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
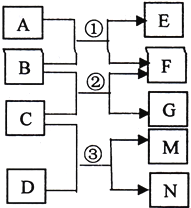
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300 mL 0.2 mol/L的 KI溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的 I2和 KIO3,则消耗 KMnO4的物质的量是___mol。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是___,又变为棕黄色的原因是(用离子方程式解释)____。
(3)在 100 mLFeBr2 溶液中通入标准状况下3.36 L Cl2,溶液中有![]() 的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为_____mol/L。
的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为_____mol/L。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式____。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com