【题目】如图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色.请根据上述信息回答: 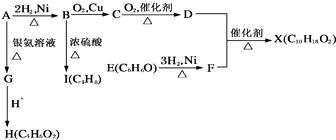
请回答下列问题:
(1)H中含氧官能团的名称是 . B→I的反应类型为 .
(2)只用一种试剂鉴别D、E、H,该试剂是 .
(3)D和F反应生成X的化学方程式为 .
参考答案:
【答案】
(1)羧基;消去反应
(2)溴水
(3)![]()
【解析】解:A和氢气发生加成反应生成B,B的结构简式为:CH3CH2CH2CH2OH,B被氧气氧化生成醛C,C的结构简式为:CH3CH2CH2CHO,C被氧化生成酸D,D的结构简式为:CH3CH2CH2COOH,A和银氨溶液反应生成G,则G的结构简式为:CH2=CHCH2COONH4 , G被酸化生成H,H的结构简式为:CH2=CHCH2COOH,E与FeCl3溶液作用显紫色说明E中含有酚羟基,结合其分子式知,E的结构简式为: ![]() ,E和氢气发生加成反应生成F,则F的结构简式为:
,E和氢气发生加成反应生成F,则F的结构简式为: ![]() ,F和D发生酯化反应生成X,则X的结构简式为:
,F和D发生酯化反应生成X,则X的结构简式为: 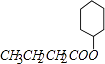 ,在浓硫酸作用下,B发生消去反应生成I,I的结构简式为:CH3CH2CH=CH2。
,在浓硫酸作用下,B发生消去反应生成I,I的结构简式为:CH3CH2CH=CH2。
(1.)X是一种具有水果香味的合成香料,应属于酯,据E的分子式可以得到是苯酚,A是能发生银镜反应的直链化合物,所以A是含一个双键的直链醛,B是A加成还原得到的1﹣丁醇,C是丁醛,D是丁酸.F是环己醇;H是含一个双键的直链羧酸,I是B发生消去反应得到的1﹣丁烯,所以答案是:羧基;消去反应;
(2.)D、E、H分别是丁酸、苯酚、不饱和丁酸,鉴别从双键和苯酚入手,选用溴水,所以答案是:溴水;
(3.)D是丁酸,F是环己醇,二者发生酯化反应,反应方程式为: ![]() ,
,
所以答案是: ![]() .
.
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是

A. 根据右图对照试验实验1、2的现象可推知:用砂纸打磨后的铝片分别与c(H+)均为0.2 mol L-1 的盐酸和硫酸反应,后者更剧烈
B. 右图实验2中生成红色物质的离子方程式:Al+Cu2+=Al3++Cu
C. 探究FeCl3和KI溶液反应限度:将1mL0.1mol L-1 FeCl3溶液加入到5 mL 0.1mol L-1KI溶液中,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察现象
D. 水电离出的c(H+)=10-10 mol L-1的溶液:Na+、K+、Cl-、HCO3-可以共存
-
科目: 来源: 题型:
查看答案和解析>>【题目】探究题
Ⅰ.某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.
(1)写出A的结构简式 .
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”).
(3)Ⅱ.2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭.“亮菌甲素”的结构简式为: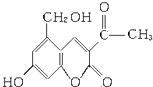
它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
①下列有关“亮菌甲素”的叙述正确的是(填字母).
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”的分子式是C12H10O5
D.“亮菌甲素”分子中含氧官能团只有2种
②丙二醇的分子式是C3H8O2 , 已知两个羟基连在同一个碳原子上的物质不存在.写出其所有属于醇类的同分异构体的结构简式.
③依据核磁共振氢谱分析,二甘醇分子中有3个吸收峰,其峰面积之比为2:2:1.又知二甘醇中含碳、氧元素的质量分数相同,且氢元素的质量分数为9.4%,1mol二甘醇与足量金属钠反应生成1mol H2 . 写出二甘醇的结构简式. . -
科目: 来源: 题型:
查看答案和解析>>【题目】下列属于物理变化的是
A.炸药爆炸B.干冰的气化C.烃的裂解D.铁生锈
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属钠投入到下列溶液中,既有气体放出,又有蓝色沉淀生成的是( )
A. 盐酸 B. 氯化钠溶液
C. 氯化铜溶液 D. 氯化镁溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大.A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒.
(1)A元素的第一电离能B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为(用元素符号表示).
(2)D元素原子的价电子排布式是 .
(3)C元素的电子排布图为;E3+的离子符号为 .
(4)F元素位于元素周期表的区,其基态原子的电子排布式为 .
(5)G元素可能的性质 .
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸. -
科目: 来源: 题型:
查看答案和解析>>【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出.
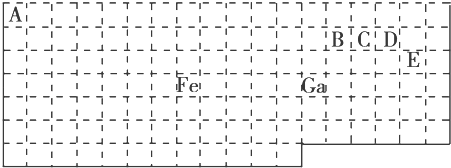
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为
(2)铁元素位于元素周期表的区;Fe和CO易形成配合物Fe(CO)5 , 在Fe(CO)5中铁的化合价为 .
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO互为等电子体的分子和离子分别为和(填化学式).
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 .
(5)根据VSEPR模型预测ED4﹣的空间构型为 . B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为(写2种).
相关试题

