【题目】相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g)△H=一92kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=一92kJ/mol。实验测得起始、平衡时的有关数据如下表:

下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/3
C.容器②中达平衡时放出的热量Q=46 kJ
D.若容器①体积为2L,则平衡时放出的热量<46kJ
参考答案:
【答案】C
【解析】
试题分析:A、平衡常数只与温度有关,相同温度下,体积均为1L的两个恒容密闭容器中发生相同的反应,则平衡常数应相同,A正确;B、①容器中放出46kJ热量,则消耗的氨气的物质的量为:![]() =0.5mol,则根据方程式可知
=0.5mol,则根据方程式可知
N2(g)+3H2(g)![]() 2NH3(g)△H=一92kJ/mol
2NH3(g)△H=一92kJ/mol
起始量(mol)1 3 0
转化量(mol)0.5 1.5 1
平衡量(mol)0.5 1.5 1
平衡时,①容器中NH3的体积分数等于气体的物质的量分数=![]() ,从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,B正确;C、②中含有0.2molNH3相当在①的基础上加入氨气,抑制平衡正向移动,则平衡时放出的热量小于46kJ,C错误;D、若容器①体积为2L,相当于在原来的基础上减小压强,平衡逆向移动,平衡时放出的热量小于46kJ,D正确,答案选C。
,从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,B正确;C、②中含有0.2molNH3相当在①的基础上加入氨气,抑制平衡正向移动,则平衡时放出的热量小于46kJ,C错误;D、若容器①体积为2L,相当于在原来的基础上减小压强,平衡逆向移动,平衡时放出的热量小于46kJ,D正确,答案选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图中,表示2A(g)+B(g)
 2C(g) △H<0这个可逆反应的正确图像为[注:φ(C)表示体系中物质C的百分含量;体系中压强的增大为压缩体积的结果]
2C(g) △H<0这个可逆反应的正确图像为[注:φ(C)表示体系中物质C的百分含量;体系中压强的增大为压缩体积的结果]

A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】酚醛树脂是应用广泛的高分子材料,可用酚类与醛类在酸或碱的催化下相互缩合而成,类似的合成过程如:
反应①

反应②

(1)化合物Ⅰ的分子式______。
(2)苯酚与浓溴水反应的化学方程式为__________________。
(3)化合物Ⅱ
 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为___________________________________;写出有机物Ⅱ与足量NaHCO3反应的化学方程式________________________________。
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为___________________________________;写出有机物Ⅱ与足量NaHCO3反应的化学方程式________________________________。(4)有关化合物Ⅱ和Ⅲ的说法正确的有____(填字母)。
A.都属于芳香烃 B.含有官能团种类相同,性质也完全相同
C.二者互为同系物 D.1mol的Ⅱ或Ⅲ都能与2mol的NaOH完全反应
(5)符合下列有条件的化合物Ⅱ的同分异构体有_________种,写出其中苯环上一元取代只有两种的异构体的结构简式_________________________________。
①遇FeCl3溶液发生显色反应 ②可以发生银镜反应 ③可以发生水解反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是 )
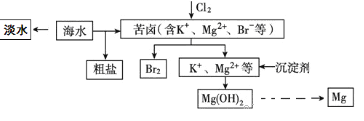
A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
B. 空气吹出法是工业规模海水提溴的常用方法。其工艺的其中一个环节是把氯气通入酸化的浓缩海水(或苦卤)中。
C. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂。
D. 由Mg(OH)2可以制得MgCl2·6H2O,某兴趣小组同学设计了如下装置制取无水MgCl2。其中装置A的作用是制取干燥的HCl气体。
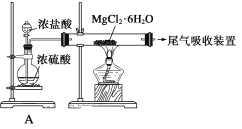
-
科目: 来源: 题型:
查看答案和解析>>【题目】接触法制硫酸的工业生产主要分为三步:第一步,矿石燃烧的设备叫_______,其中发生的主要反应式是_______;第二步制备三氧化硫的设备是_______,发生的主要化学反应方程式是:_______;第三步用_______而不用水吸收的主要原因是_______;最后的尾气中所含污染空气的主要有害物质是_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】质量比为2∶3的金属铝分别跟足量稀硫酸和氢氧化钠溶液反应,则产生氢气体积比是 ( )
A.1∶2B.1∶3C.2∶3D.3∶2
-
科目: 来源: 题型:
查看答案和解析>>【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是()

A. d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D. a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
相关试题

