
【题目】研究物质的结构,用来探寻物质的性质,是我们学习化学的重要方法。回答下列问题:
(1)Fe、Ru、Os在元素周期表中处于同一列,人们已经发现和应用了Ru、Os的四氧化物。量子化学理论预测铁也存在四氧化物,但最终人们发现铁的化合价不是+8而是+6。OsO4分子空间形状是____________,铁的“四氧化物”分子中,铁的价电子排布式是____________,氧的化合价是___________。
(2)NH3分子中H—N—H键角为106.7°,在Ag(NH3)2+中,H—N—H键角近似109.5°,键角变大的原因是_______________________。
(3)氢键的本质是缺电子的氢原子和富电子的原子或原子团之间的一种弱的电性作用。近年来,人们发现了双氢键,双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用。下列不可能形成双氢键的是_______。
a.Be—H…H—O b.O—H…H—N c.B—H…H—N d.Si—H…H—Al
(4)冰晶石(Na3A1F6)主要用作电解氧化铝的助熔剂,也用作研磨产品的耐磨添加剂。其晶胞结构如图所示,晶胞是正四棱柱形状,Na(I)位于侧棱中心和底面中心,Na(II)位于四个侧面上,AlF63-位于顶点和体心。
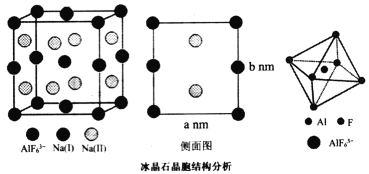
AlF![]() 中,中心原子周围的成键电子总数是________个。若用原子坐标来描述晶胞中所有Na原子的位置,则需要________组原子坐标。己知晶胞边长为a nm,b nm,冰晶石晶体的密度为__________g·cm-3(Na3AlF6的摩尔质量为210g·mol-1)。
中,中心原子周围的成键电子总数是________个。若用原子坐标来描述晶胞中所有Na原子的位置,则需要________组原子坐标。己知晶胞边长为a nm,b nm,冰晶石晶体的密度为__________g·cm-3(Na3AlF6的摩尔质量为210g·mol-1)。
【答案】正四面体 3d2 -1,-2 [Ag(NH3)2]+中,配位键N-Ag键的成键电子对相比NH3中的孤电子对N-H键的排斥力变小,故[Ag(NH3)2]+中H-N-H键角变大 bd 12 6 ![]()
【解析】
(1)Fe、Ru、Os在元素周期表中处于同一列,性质有相似性。OsO4分子空间形状与FeO4相同,是正四面体,铁的“四氧化物”分子中,正六价的铁核外的3d轨道上的值为3+0.4×2=3.8,而4s轨道为4+0.4×0=4.0,3d<4s,所以铁的价电子排布式是3d2,铁的化合价为+6,即氧的化合价是-1,-2。
(2)NH3分子中H—N—H键角为106.7°,在Ag(NH3)2+中,H—N—H键角近似109.5°,键角变大的原因是[Ag(NH3)2]+中,配位键N-Ag键的成键电子对相比NH3中的孤电子对N-H键的排斥力变小,故[Ag(NH3)2]+中H-N-H键角变大。
(3)氢键的本质是缺电子的氢原子和富电子的原子或原子团之间的一种弱的电性作用。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用。
a.Be—H中氢原子带负电,H—O中氢原子带正电,符合双氢键定义;
b.O—H和H—N中氢原子均带正电,不符合题意;
c.B—H中氢原子带负电,H—N中中氢原子带正电,符合双氢键定义;
d.Si—H…H—Al中氢原子均带负电,不符合题意。
答案为bd。
(4)冰晶石(Na3A1F6)晶胞是正四棱柱形状,Na(I)位于侧棱中心和底面中心,Na(II)位于四个侧面上,AlF63-位于顶点和体心。
根据结构可知,AlF![]() 中,中心原子周围的成键电子总数是12个。若用原子坐标来描述晶胞中所有Na原子的位置,则需要6组原子坐标。己知晶胞边长为a nm,b nm,冰晶石晶体的密度为
中,中心原子周围的成键电子总数是12个。若用原子坐标来描述晶胞中所有Na原子的位置,则需要6组原子坐标。己知晶胞边长为a nm,b nm,冰晶石晶体的密度为![]()
![]() g·cm-3(Na3AlF6的摩尔质量为210g·mol-1)。
g·cm-3(Na3AlF6的摩尔质量为210g·mol-1)。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.甲苯既可使溴的CCl4溶液褪色,也可使KMnO4酸性溶液褪色
B.有机物![]() 的消去产物有2种
的消去产物有2种
C.鉴别乙醇和苯:将少量的酸性KMnO4溶液分别滴入少量的乙醇和苯中
D.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CHCOOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置探究C12和NO2在NaOH溶液中的反应。通入适当比例的C12和NO2,发生的化学反应为C12+2NO2+4NaOH===2NaNO3+2NaC1+2H2O。下列叙述正确的是
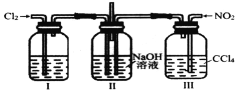
A.实验室中可用Cu与1mol·L-1的硝酸制备二氧化氮气体
B.装置II中的玻璃管起到平衡气压作用,可将多余气体直接排出
C.由该反应可知氧化性顺序:C12>NO2>NaNO3
D.通过观察装置I、III中的气泡的快慢控制C12和NO2的通入量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H)。下列说法错误的是
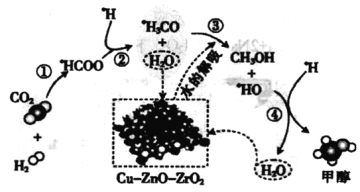
A.催化剂不能提高二氧化碳加氢制甲醇的过程中原子利用率
B.该反应过程中,涉及了极性共价键的断裂和生成
C.第③步的反应式为*H3CO+H2O→CH3O*H+HO
D.向该反应体系中加入少量的水能增加甲醇的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用特殊电极材料制作的新型二次电池,放电时发生如下图所示的电极反应,下列说法正确的是
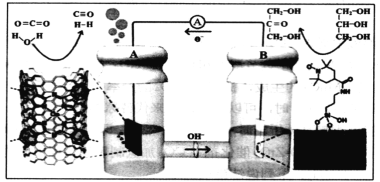
A.A为原电池的负极,失去电子,发生氧化反应
B.B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-=CH2OHCOCH2OH+2H+
C.若通过交换膜的离子是HCO![]() ,则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO
,则B上发生的电极反应为CH2OH(CHOH)CH2OH—2e-+2HCO![]() =CH2OHCOCH2OH+2H2O+2CO2
=CH2OHCOCH2OH+2H2O+2CO2
D.若A处产生的CO和H2的物质的量之比为1:3,则B处消耗丙三醇的物质的量为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化氮-空气质子交换膜燃料电池将化学能转化为电能,实现了制硝酸、发电环保三位一体的结合。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为(NH4)2SO4的原理和粗铜的精炼原理。
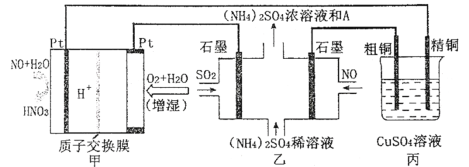
(1)燃料电池放电过程中负极的电极反应式____。
(2)乙装置中物质A是____(填化学式),理由是___;电解过程中阳极附近pH___(填“增大”“减小”或“不变”),阴极的电极反应式是____。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,CuSO4溶液的浓度将__(填“增大”、“减小”或“不变”)。
(4)若在标准状况下,甲装置有22.4 L O2参加反应,则乙装置中转化SO2和NO的物质的量共有____mol;丙装置中阴极析出铜的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增加,X原子的半径小于Y原子,Y是地壳中含量最高的元素,Z原子的最外层只有1个电子,Y、W同主族。下列说法正确的是( )
A.原子半径:![]() B.Y与Z形成的化合物中只含离子键
B.Y与Z形成的化合物中只含离子键
C.W元素形成的最高价氧化物的水化物是强酸D.X与Z形成的化合物中X为![]() 价
价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有三个峰,峰面积之比是1:1:6,则该化合物的结构简式为
A.CH3-O-CH2-CH3B.![]()
C.CH3CH2CH2OHD.C3H7OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸钠![]() 可用于化学镀镍。将黄磷
可用于化学镀镍。将黄磷![]() 和过量烧碱溶液混合、加热,生成次磷酸钠和
和过量烧碱溶液混合、加热,生成次磷酸钠和![]() ,
,![]() 是一种无色、有毒的可燃性气体,与
是一种无色、有毒的可燃性气体,与![]() 溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
溶液反应也可生成次磷酸钠。实验室可用下列装置来制取次磷酸钠。实验的有关操作步骤如下:
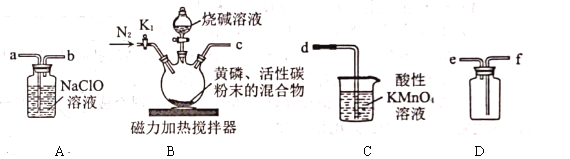
①装好药品,②连接装置,检查气密性,③打开![]() ,再通入一段时间
,再通入一段时间![]() ,④将反应所得的次磷酸钠分离出来,⑤关闭
,④将反应所得的次磷酸钠分离出来,⑤关闭![]() ,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开
,滴加烧碱溶液,再打开磁力加热搅拌器,⑥打开![]() 通入
通入![]() 一段时间。请回答下列问题:
一段时间。请回答下列问题:
(1)正确实验操作步骤的顺序是________(填序号)。
(2)实验装置中各导管口的连接顺序是________(填装置中的小写字母)。
(3)在黄磷中混入活性炭粉末的作用是________。
(4)先滴加烧碱溶液,再打开磁力加热搅拌器可能的原因是________。
(5)装置![]() 中反应的化学方程式是________。
中反应的化学方程式是________。
(6)![]() 和
和![]() 的溶解度
的溶解度![]() 如下:
如下:
|
| |
| 37 | 39 |
| 100 | 667 |
实验结束后,将A中混合液蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为________,然后________、冷却结晶、过滤、洗涤、干燥,得到含![]() 的粗产品。
的粗产品。
(7)测定产品的纯度:取产品![]() 克配成
克配成![]() 溶液,取
溶液,取![]() 于锥形瓶中,酸化后加入
于锥形瓶中,酸化后加入![]() 碘水于暗处充分反应得
碘水于暗处充分反应得![]() ,然后以淀粉溶液作指示剂,用
,然后以淀粉溶液作指示剂,用![]() 溶液滴定至终点,平均消耗
溶液滴定至终点,平均消耗![]() ,若其它杂质不参加反应,则产品纯度表达式为________。(已知:
,若其它杂质不参加反应,则产品纯度表达式为________。(已知:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com