
【题目】在一定温度下,醋酸溶液中存在电离平衡:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+) 与0.01 mol·L-1 的醋酸溶液中的c(H+)的比值 ____(填“大于”“小于”或“等于”)10,理由是_________。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是:_____________。
A.c(H+) B.![]() C.c(H+)·c(OH) D.c(OH)/c(H+)
C.c(H+)·c(OH) D.c(OH)/c(H+)
(3)现有pH均为3的醋酸、硫酸两瓶溶液:
①设两种溶液的物质的量浓度依次为c1、c2,则其关系式为_________(用“<”“>”或“=”表示,下同)。
②取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入少量等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式为_______,反应结束放出的氢气的体积依次为V1、V2,则其关系式为_____。
【答案】小于 浓度越稀,醋酸越容易电离 A c1>c2 v1>v2 V1=V2
【解析】
稀溶液稀释过程中,促进弱电解质电离平衡向电离方向移动,但电离常数不变。区分溶液浓度、溶液中氢离子浓度与溶液pH的关系,进而判断化学反应的速率。
(1)某温度时,将0.1 mol·L-1醋酸溶液稀释10倍得0.01 mol·L-1 醋酸溶液。若稀释过程中电离平衡(CH3COOH ![]() CH3COO- + H+)不移动,则稀释前后c(H+)之比等于10。事实上,稀释电离平衡右移,故稀释前后c(H+)之比小于10。
CH3COO- + H+)不移动,则稀释前后c(H+)之比等于10。事实上,稀释电离平衡右移,故稀释前后c(H+)之比小于10。
(2)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程中,电离平衡(CH3COOH ![]() CH3COO-+H+)右移,溶液中n(H+)增大、c(H+)减小。c(CH3COO-)也减小,但KW=
CH3COO-+H+)右移,溶液中n(H+)增大、c(H+)减小。c(CH3COO-)也减小,但KW=![]() 不变,则
不变,则![]() 增大。c(H+)·c(OH)=KW不变。c(H+)减小,则c(OH)增大,c(OH)/c(H+)增大,故选A。
增大。c(H+)·c(OH)=KW不变。c(H+)减小,则c(OH)增大,c(OH)/c(H+)增大,故选A。
(3)①pH均为3的醋酸、硫酸两瓶溶液中,c(H+)都等于0.001 mol/L。因CH3COOH ![]() CH3COO-+H+,醋酸溶液浓度c1>0.001 mol/L;又H2SO4=2H++SO42-,硫酸溶液浓度c2=0.0005 mol/L,故c1>c2。
CH3COO-+H+,醋酸溶液浓度c1>0.001 mol/L;又H2SO4=2H++SO42-,硫酸溶液浓度c2=0.0005 mol/L,故c1>c2。
②相同体积的两种酸分别加入等体积的蒸馏水后,因CH3COOH电离平衡右移,醋酸中c(H+)比硫酸中大,与锌反应较快,即v1>v2。因锌粉少量且等量,反应结束放出的氢气在同温同压时体积相等,即V1=V2。


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】铜是重要的工业原料,现有![]() 、
、![]() 组成的混合物,某研究性学习小组为了探究其组成情况,取
组成的混合物,某研究性学习小组为了探究其组成情况,取![]() 该混合物加入
该混合物加入![]() 的稀硝酸中,固体物质完全反应,生成
的稀硝酸中,固体物质完全反应,生成![]() (标准状况)的
(标准状况)的![]() 。向所得溶液中加入
。向所得溶液中加入![]() 的
的![]() 溶液,恰好使溶液中的
溶液,恰好使溶液中的![]() 沉淀完全。
沉淀完全。
(1)![]() 与稀硝酸反应的化学方程式为____________。
与稀硝酸反应的化学方程式为____________。
(2)混合物中,![]() ______;
______;![]() ________。
________。
(3)![]() ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞作指示剂)的滴定曲线,下列说法正确的是
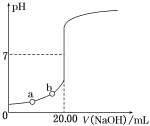
A. 水电离出的氢离子浓度:a<b
B. 盐酸的物质的量浓度为0.010 0 mol·L-1
C. 指示剂变色时,说明盐酸与NaOH恰好完全反应
D. 当滴加NaOH溶液为10.00 mL时,该混合液的pH=1+lg 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(Ⅰ)、(Ⅱ)反应在一定条件下焓变及平衡常数如下:
2H2(g)+S2(g)2H2S(g) ΔH1 K1 (Ⅰ)
3H2(g)+SO2(g)2H2O(g)+H2S(g) ΔH2 K2 (Ⅱ)
(1)用ΔH1、ΔH2表示反应4H2(g)+2SO2(g)=S2(g)+4H2O(g)的ΔH=________。
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1 L恒容容器中加入1.8 mol H2、1.2 mol S2,10 min时反应达到平衡。测得10 min内v(H2S)=0.08 mol·L-1·min-1,则该条件下的平衡常数为________。
②温度为T2时(T2>T1),在1 L恒容容器中也加入1.8 mol H2、1.2 mol S2,建立平衡时测得S2的转化率为25%,据此判断ΔH1________0(填“>”或“<”),与T1时相比,平衡常数K1__(填“增大”“减小”或“不变”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的水解平衡常数=________。
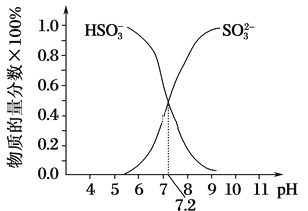
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. ![]() U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。![]() U的浓缩一直为国际社会关注。回答下列有关问题:
U的浓缩一直为国际社会关注。回答下列有关问题:
(1)![]() U的中子数是___。
U的中子数是___。
(2)![]() U、
U、![]() U、
U、![]() U互为同位素,下列对同位素的理解不正确的是___(填序号,下同)。
U互为同位素,下列对同位素的理解不正确的是___(填序号,下同)。
A.元素符号相同 B.物理性质相同 C.化学性质基本相同 D.在周期表中位置相同
(3)下列有关![]() U说法不正确的是___。
U说法不正确的是___。
A.![]() U原子核内中子数与质子数之差为51
U原子核内中子数与质子数之差为51
B.![]() U与
U与![]() U的质子数、电子数都相等
U的质子数、电子数都相等
C.![]() U与
U与![]() U是两种质子数相同,中子数不同的原子
U是两种质子数相同,中子数不同的原子
D. ![]() U与
U与![]() U是同种原子
U是同种原子
Ⅱ.锂的材料在社会生活中广泛应用,如亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,LiCoO2用作便携式电源的正极材料,碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域。根据下列要求回答相关问题:
(1)![]() Li和
Li和![]() Li用作核反应堆最佳载热体,
Li用作核反应堆最佳载热体,![]() LiH和
LiH和![]() LiD用作高温堆减速剂。下列说法中正确的是_______(填序号,下同)。
LiD用作高温堆减速剂。下列说法中正确的是_______(填序号,下同)。
A. ![]() Li和
Li和![]() Li互为同位素 B
Li互为同位素 B![]() Li和
Li和![]() Li属于同种核素
Li属于同种核素
C.![]() LiH和
LiH和![]() LiD的化学性质不同 D.
LiD的化学性质不同 D.![]() LiH和
LiH和![]() LiD是同种物质
LiD是同种物质
(2)下列说法不正确的是_________。
A.碱性:Be(OH)2<LiOH<NaOH<KOH B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+ D.金属性:Cs>Rb>K>Na>Li>Be
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 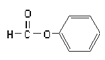 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 X、Y、Z 三种元素,X 是有机化合物中必含的元素, Y 是地壳里含量最多的元素,Z 是质量最轻的元素。X、Y、Z 三种元素组成的有机物 M 能被酸性高锰酸钾氧化生成 N。为了测定有机物 M 的结构,做如下实验:
①将 4.6 g 有机物 M 完全燃烧,测得生成 0.2mol CO2 和 5.4 g 水;
②用质谱仪检测有机物 M,得到如图一所示的质谱图;
③用核磁共振仪处理有机物 M,得到如图二所示图谱,图中三个峰面积之比为1:2:3
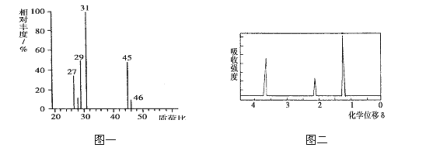
试回答下列问题:
⑴M 的结构简式是______________。
⑵N 中含有的官能团的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一无色透明的溶液做如下实验:
①取少量溶液滴加盐酸酸化的BaCl2溶液有白色沉淀生成。
②另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示,试问:
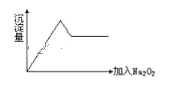
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、K+、SO42-等离子中一定存在的离子是__;可能存在的离子是__;一定不存在的离子是___。
(2)上述溶液至少由___等物质混合成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com