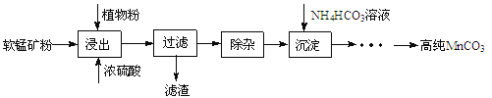
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )
A.试剂X可以是MnO、MnO2、MnCO3等物质
B.浸出时加入植物粉的作用是作为还原剂
C.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
【答案】B
【解析】
软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)中Mn元素显+4价,浸出并过滤后Mn元素以Mn2+的形式存在于滤液中,浓硫酸无还原性,据此可推知植物粉作还原剂;浸出后的滤液中,除了Mn2+还有Fe2+、Al3+、Mg2+,除杂时可调节pH使其中一些离子转化为沉淀,为了不引入新的杂质,可加入Mn(Ⅱ)的氧化物或碳酸盐;除杂过程中调节浸出液的pH为3.5~5.5,不能将Fe2+、Al3+、Mg2+完全转化为沉淀,之后加入双氧水可将Fe2+氧化为更易沉淀的Fe3+,加入的软锰矿也会再消耗一些H+;NH4HCO3受热易分解,因此加入NH4HCO3沉淀Mn2+时,温度不宜过高。
A.试剂X用于调节pH,为了不引入新的杂质,可加入Mn(Ⅱ)的氧化物或碳酸盐,不宜加入MnO2,A项错误;
B.浸出时,MnO2转化为Mn2+,植物粉作还原剂,B项正确;
C.除杂过程中调节浸出液的pH为3.5~5.5不能完全除去Fe、Al、Mg等杂质,C项错误;
D.沉淀MnCO3步骤中,NH4HCO3受热易分解,不能持续升高温度,D项错误;
答案选B。

