
【题目】已知苯与液溴的反应是放热反应,某校学生为探究苯与溴发生的反应,用如图装置进行实验。根据相关知识回答下列问题:
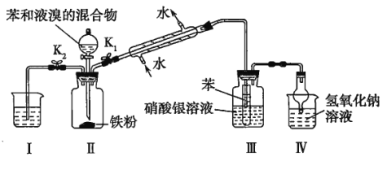
(1)实验开始时,关闭K2,打开K1和漏斗活塞,滴加苯和液溴的混合液,反应开始。一段时间后,在装置Ⅲ中可能观察到的现象是_________。
(2)实验中能防止倒吸的装置有___________(填装置序号)。
(3)反应结束后要使装置Ⅰ中的水倒吸入装置Ⅱ中。这样操作的目的是_________,简述这一操作:________。
(4)通过该实验,可知苯与溴的反应是_______反应。
【答案】小试管中有气泡,液体变橙红色,有白雾出现,广口瓶内溶液中有浅黄色沉淀生成 Ⅲ和Ⅳ 除去装置Ⅱ中存有的溴化氢气体,以免![]() 逸出污染空气 关闭
逸出污染空气 关闭![]() 和漏斗活塞,打开
和漏斗活塞,打开![]() 取代
取代
【解析】
苯和液溴在溴化铁催化下发生取代反应生成溴苯和溴化氢,该反应是放热的,所以用冷凝管冷凝回流挥发的苯和液溴。生成的溴化氢和挥发的苯蒸气、溴蒸气进入装置Ⅲ的苯中,苯蒸气和溴蒸气被苯吸收,溴化氢不溶于苯,从苯中逸出,和硝酸银溶液反应生成溴化银淡黄色沉淀,过量的溴化氢进入Ⅳ中,被氢氧化钠溶液吸收,由于溴化氢极易溶于氢氧化钠溶液,所以用一干燥管防倒吸。反应结束后,关闭K1和分液漏斗活塞,打开K2,Ⅰ中的水倒吸入Ⅱ中,可以吸收Ⅱ中的溴化氢,防止拆卸装置时污染环境。
(1)反应一段时间后,生成的溴化氢和挥发的苯蒸气、溴蒸气进入装置Ⅲ的苯中,苯蒸气和溴蒸气被苯吸收,溴溶于苯呈现橙色,溴化氢不溶于苯,从苯中逸出,和硝酸银溶液反应生成溴化银淡黄色沉淀,所以在装置Ⅲ中可能观察到的现象是小试管中有气泡,液体变橙红色,有白雾出现,广口瓶内溶液中有浅黄色沉淀生成。
(2)溴化氢极易溶于水,装置Ⅲ中导管没有直接插入硝酸银溶液里,而是插入苯中,既吸收了挥发的苯和溴,也防止了溴化氢的倒吸;装置Ⅳ用干燥管也可以起到防倒吸的作用,故实验中能防止倒吸的装置有Ⅲ和Ⅳ。
(3)反应结束后,关闭K1和分液漏斗活塞,打开K2,Ⅰ中的水倒吸入Ⅱ中,可以吸收Ⅱ中的溴化氢,防止拆卸装置时污染环境。故答案为除去装置Ⅱ中存有的溴化氢气体,以免![]() 逸出污染空气,关闭
逸出污染空气,关闭![]() 和漏斗活塞,打开
和漏斗活塞,打开![]() 。
。
(4)苯和溴若发生加成,则只有一种有机物生成,没有溴化氢生成。苯和溴若发生取代,则会有溴化氢生成,该实验中看到装置Ⅲ中小试管中有气泡,同时有白雾出现,广口瓶内溶液中有浅黄色沉淀生成,可以证明生成了溴化氢,证明苯和溴发生了取代反应。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用![]() 表示。极性分子的极性强弱与偶极长和电荷量(
表示。极性分子的极性强弱与偶极长和电荷量(![]() )有关,一般用偶极矩(
)有关,一般用偶极矩(![]() )来衡量。分子的偶极矩是偶极长和电荷量的乘积,即
)来衡量。分子的偶极矩是偶极长和电荷量的乘积,即![]() 。在非极性分子中,其正、负电荷重心重合,故
。在非极性分子中,其正、负电荷重心重合,故![]() 为0。试回答下列问题:
为0。试回答下列问题:
(1)HCl、CS2、H2S、SO2四种分子中![]() 的有______________________________。
的有______________________________。
(2)实验测得:![]()
①由此可知,PF3分子的空间构型为____________________;
②BCl3分子的空间构型为____________________,中心原子的杂化方式为____________________。
(3)治癌药物![]() 具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的
具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的![]() ,淡黄色化合物的
,淡黄色化合物的![]() 。试写出两种同分异构体的结构简式:____________________(棕黄色)、____________________(淡黄色),在水中溶解度较大的是____________________(填结构简式)。
。试写出两种同分异构体的结构简式:____________________(棕黄色)、____________________(淡黄色),在水中溶解度较大的是____________________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下HF酸性强于HCN,分别向1Ll mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化),溶液中 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
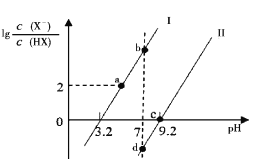
A.直线I对应的是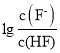
B.I中a点到b点的过程中水的电离程度逐渐增大
C.c点溶液中:![]()
![]()
D.b点溶液和d点溶液相比:cb(Na+)<cd(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
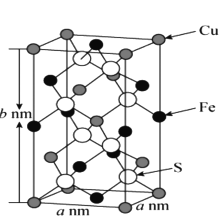
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 的说法正确的是( )
的说法正确的是( )
A.该有机物的分子式为![]() ,属于苯的同系物
,属于苯的同系物
B.![]() 该有机物与溴水发生加成反应最多消耗
该有机物与溴水发生加成反应最多消耗![]() ,与氢气发生加成反应最多消耗
,与氢气发生加成反应最多消耗![]()
C.该有机物分子中至少有4个碳原子共直线,最多有13个碳原子共平面
D.该有机物在一定条件下可发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了如下三个实验方案,探究用化学方法检验淀粉的水解情况。
方案甲:![]() 结论:淀粉完全水解
结论:淀粉完全水解
方案乙:![]() 结论:淀粉完全没有水解
结论:淀粉完全没有水解
方案丙:![]() 结论:淀粉已经水解
结论:淀粉已经水解
试从实验操作、结论两个方面对上述三种方案进行评价,其中正确的是____,理由是______,有错误的是_____,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如图,图中“棍”代表单键或双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该有机物的叙述不正确的是

A.有机物化学式为C2HCl3B.可由乙炔和氯化氢加成得到
C.该有机物难溶于水![]() D.分子中所有原子在同一个平面内
D.分子中所有原子在同一个平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物在食品、药物、材料等领域发挥着举足轻重的作用。下列说法正确的是( )
A.甲苯和间二甲苯的一溴代物均有4种
B.按系统命名法,化合物(CH3)2C(OH)C(CH3)3的名称为2,2,3-三甲基-3-丁醇
C.2-丁烯分子中的四个碳原子在同一直线上
D.乙酸甲酯分子在核磁共振氢谱中只能出现一组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:__。
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=___。
②在该温度下反应的平衡常数K=___。
③关于上述反应,下列叙述正确的是___(填字母)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:

若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ___(不要求标出CO的终点坐标)。
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:

请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com