【题目】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
I. Cl2的制备。
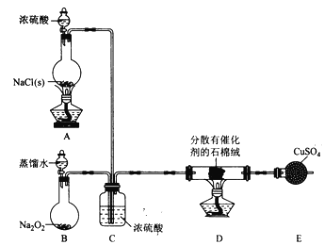
(1)装置B中发生反应的化学方程式为____________________。
(2)装置C的作用除干燥气体外还有_________________。
(3)装置 E中盛放CuSO4的仪器名称为_______________;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为_____________________。
II. Cl2性质的验证。
该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
査阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
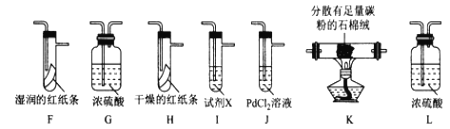
(4)按气流从左到右的方向,装置连接的合理顺序为E→__→__→__→__→__→__→__→尾气处理____________(填装置字母,)
(5)试剂X的名称为____________。
(6)装置J中发生反应的化学方程式为_________________。
(7)设计实验证明经净化后的Cl2中不含HC1:_______________
参考答案:
【答案】 2Na2O2+2H2O=4NaOH+O2 控制气体的流速和比例、使气体混合均匀 (球形)干燥管 4HCl+O2![]() 2H2O+ 2Cl2 G(或L)KJL(或G )HFI 硫化钠溶液(其他合理答案也给分) PdCl2+CO+H2O=Pd+CO2+2HCl 将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸,试纸不变红(或通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HCl
2H2O+ 2Cl2 G(或L)KJL(或G )HFI 硫化钠溶液(其他合理答案也给分) PdCl2+CO+H2O=Pd+CO2+2HCl 将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸,试纸不变红(或通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HCl
【解析】I.由题意,A为制取HCl装置;B为制取O2装置;C处浓硫酸吸水干燥,还可以通过导管口气泡的情况,调节HCl和O2的流速,使两种气体按一定比例充分混合,在D中反应制取氯气;E为检验有水生成的装置。
(1)B中过氧化钠和水反应制取氧气,反应化学方程式为:2Na2O2+2H2O=4NaOH+O2↑。
(2)装置C除了干燥气体外,还可以根据导管口气泡的情况,调节HCl和O2的流速,使两种气体按一定比例混合均匀。
(3)E为球形干燥管,反应开始后,E中硫酸铜变蓝,则装置D中有水生成,由题意,反应化学方程式为:4HCl+O2![]() 2H2O+2Cl2。
2H2O+2Cl2。
II.该小组用实验I中制得的Cl2和如图所示装置(不能重复使用)验证干燥纯净的Cl2的性质,应除去水蒸气和O2,结合所给三条信息,K装置发生2C+O2![]() 2CO,从而除去O2;I中应盛有硫化钠或硫化钾溶液,通过反应:Cl2+Na2S=2NaCl+S↓,验证Cl的非金属性强于S;J为吸收CO的装置。
2CO,从而除去O2;I中应盛有硫化钠或硫化钾溶液,通过反应:Cl2+Na2S=2NaCl+S↓,验证Cl的非金属性强于S;J为吸收CO的装置。
(4)由上述分析,先除去水蒸气和氧气,再捕获CO,然后检验漂白性,最后检验非金属性强弱。按气流从左到右的方向,装置连接的合理顺序为E→G(L)→K→J→L(G)→H→F→I→尾气处理。
(5)I中应盛有硫化钠或硫化钾溶液,通过反应:Cl2+Na2S=2NaC1+S↓,验证Cl的非金属性强于S。
(6)由①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物;可得装置J中发生反应的化学方程式为:PdCl2+CO+H2O=Pd+CO2+2HCl。
(7)因为Cl2和HCl都是酸性气体,故要证明经净化后的Cl2中不含HC1,必须利用Cl2易溶于有机溶剂的性质,实验过程为:将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸(或湿润的pH试纸),试纸不变红(或通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HCl。
-
科目: 来源: 题型:
查看答案和解析>>【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)氯化水解法生产三氯氧磷的化学方程式为___________________________。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用20 mL H3PO3溶液与同浓度的NaOH溶液40mL恰好完全反应,生成的盐为___________________(填“正盐”或“酸式盐”)。
②H3PO3中,P元素的化合价为_______________________。H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________________________。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是______________________________________。
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·Lˉ1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定选用的指示剂是__________(选填字母)。
a.FeCl2b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中若未加入硝基苯这项操作,所测Cl元素含量将会_______(填“偏大”、“偏小”或“不变”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2做原料的燃料电池,负极材料采用Pt/C.正极材料采用MnO2,可用做空军通信卫星电源,其工作原理如图所示。下列说法中不正确的是

A. 电池放电时Na+从a极区移向b极区
B. 燃料电池是一类能量转化效率高、环境友好的发电装置
C. 该电池的负极反应为BH4-+ 8OH-一8e-═BO2-+ 6H2O
D. 在电池反应中,每消耗3molH2O2,转移电子数为3NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是

A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于DNA和RNA的叙述中,正确的是( )
A. 只有细胞核含有DNA
B. DNA和RNA都是由两条核苷酸链组成
C. 组成核酸的碱基共有5种
D. RNA只分布在细胞质中
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学元素组成相同的一组化合物是
A. 核糖和核糖核酸 B. 脂肪和脂肪酶
C. 淀粉和淀粉酶 D. ATP和DNA
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示,圆底烧瓶中充满干燥的氯气,将胶头滴管中的浓氨水挤入圆底烧瓶中,发生反应:2NH3+3Cl2=N2+6HCl,同时生成白烟并发红光。回答下列问题。

(1)实验室制氨气的化学反应方程式是:____________________________。
(2)在2NH3+3Cl2=N2+6HCl反应中,氨气表现了___________的化学性质, 请列举出NH3的另一个化学性质:__________________________。
(3)实验中生成的白烟是_____________________。
(4)反应完成后,将导管插入烧杯的水面下,并打开止水夹,观察到有水吸入烧瓶中形成喷泉,当喷泉停止后,烧瓶___________(填“能”或“不能”)被水充满。
相关试题

