【化学--选修2化学与技术】
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.请回答下列问题:
(1)天然水中溶解的气体主要有 、 (填化学式).
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的 .
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使 ,而水的软化是 .
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为 ;电渗析法净化水时,使离子通过半透膜的推动力是 .
(5)某天然水中、c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L、c(HCO
)=8×10-4mol/L.要软化10m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g.
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.请回答下列问题:
(1)天然水中溶解的气体主要有
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为
(5)某天然水中、c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L、c(HCO
- 3 |
参考答案:
分析:(1)天然水中溶有氧气、氮气、二氧化碳等;
(2)蒸馏水为纯水,导电性很弱;
(3)明矾中铝离子水解生成胶体,水的软化为降低水中钙、镁离子浓度;
(4)只使水分子透过半透膜,为反渗透法;电渗析法净化水时,使离子通过半透膜的推动力,为外加电源产生的电场力或电势差;
(5)10m3这种天然水,n(Ca2+)=1.2×10-3mol/L×10×1000L=12mol,n(Mg2+)=6×10-4mol/L×10×1000L=6mol,n(HCO3-)=8×10-4mol/L×10×1000L=8mol,加碱先与碳酸氢根离子反应,然后与镁离子转化为沉淀,最后加碳酸钠除去钙离子.
(2)蒸馏水为纯水,导电性很弱;
(3)明矾中铝离子水解生成胶体,水的软化为降低水中钙、镁离子浓度;
(4)只使水分子透过半透膜,为反渗透法;电渗析法净化水时,使离子通过半透膜的推动力,为外加电源产生的电场力或电势差;
(5)10m3这种天然水,n(Ca2+)=1.2×10-3mol/L×10×1000L=12mol,n(Mg2+)=6×10-4mol/L×10×1000L=6mol,n(HCO3-)=8×10-4mol/L×10×1000L=8mol,加碱先与碳酸氢根离子反应,然后与镁离子转化为沉淀,最后加碳酸钠除去钙离子.
解答:解:(1)天然水中溶有氧气、氮气、二氧化碳等,故答案为:O2;CO2(或N2);
(2)蒸馏水为纯水,导电性很弱,则检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率,故答案为:电导率或电阻率;
(3)明矾中铝离子水解生成胶体,使水中胶体及悬浮物沉淀下来,水的软化为降低水中钙、镁离子浓度,故答案为:水中胶体及悬浮物沉淀下来;除去水中Ca2+和Mg2+;
(4)只使水分子透过半透膜,为反渗透法;电渗析法净化水时,使离子通过半透膜的推动力,为电场力或电势差,故答案为:反渗透法;电场力或电势差;
(5)10m3这种天然水,n(Ca2+)=1.2×10-3mol/L×10×1000L=12mol,n(Mg2+)=6×10-4mol/L×10×1000L=6mol,n(HCO3-)=8×10-4mol/L×10×1000L=8mol,加碱先与碳酸氢根离子反应,然后与镁离子转化为沉淀,消耗OH-为8mol+6mol×2=20mol,则Ca(OH)2的物质的量为10mol,其质量为10mol×74g/mol=740g,
最后加碳酸钠除去钙离子,n(Ca2+)=12mol+10mol=22mol,n(Na2CO3)=22mol,碱与碳酸氢根离子反应生成8mol碳酸根离子,则需要提供n(Na2CO3)=22mol-8mol=14mol,其质量为14mol×106g/mol=1484g,故答案为:740;1484.
(2)蒸馏水为纯水,导电性很弱,则检验蒸馏水的纯度时,最简单易行的方法是测定水的电导率或电阻率,故答案为:电导率或电阻率;
(3)明矾中铝离子水解生成胶体,使水中胶体及悬浮物沉淀下来,水的软化为降低水中钙、镁离子浓度,故答案为:水中胶体及悬浮物沉淀下来;除去水中Ca2+和Mg2+;
(4)只使水分子透过半透膜,为反渗透法;电渗析法净化水时,使离子通过半透膜的推动力,为电场力或电势差,故答案为:反渗透法;电场力或电势差;
(5)10m3这种天然水,n(Ca2+)=1.2×10-3mol/L×10×1000L=12mol,n(Mg2+)=6×10-4mol/L×10×1000L=6mol,n(HCO3-)=8×10-4mol/L×10×1000L=8mol,加碱先与碳酸氢根离子反应,然后与镁离子转化为沉淀,消耗OH-为8mol+6mol×2=20mol,则Ca(OH)2的物质的量为10mol,其质量为10mol×74g/mol=740g,
最后加碳酸钠除去钙离子,n(Ca2+)=12mol+10mol=22mol,n(Na2CO3)=22mol,碱与碳酸氢根离子反应生成8mol碳酸根离子,则需要提供n(Na2CO3)=22mol-8mol=14mol,其质量为14mol×106g/mol=1484g,故答案为:740;1484.
点评:本题以物质的检验及分离提纯考查化学与技术,把握化学与技术的关系为解答的关键,注意(5)中计算为解答的易错点,注意反应的先后及离子之间的反应,题目难度中等.
-
科目: 来源: 题型:
【化学_选修2化学与技术】查看答案和解析>>
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: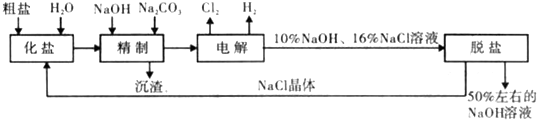
(1)在电解过程中,阳极的电极反应式为与电源负极相连的电极附近.溶液pH 值(选填“不变“、“升髙“或“下降“)
(2)铕制饱和食盐水时,为有效除去Ca2+、Mg2+、SO
,加入除杂试剂的合理顺序为2-4(选填a,b,c多选扣分),沉淀过滤后再加入HCl.
a.先加 NaOH,后加 Na2CO,再加 BaCl2 b.先加 NaOH,后加 BaCl2,再加 Na2CO3,
c.先加BaCl2,后加NaOH,再加Na2CO,d.先加Na2CO3,后加BaCl2,再加NaOH
写出沉淀过滤后,加入HCl时发生反应的离子方程式.
(3)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅含一种溶质,相应的化学方程式为
(4)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4生产NaOH和H2SO4溶液的装置.从F口可不断充入Na2SO4.
请分析:①a为(填“阳“或“阴“)离子交换膜;
②从D 口流出的溶液为.(填溶质化学式) -
科目: 来源: 题型:
【化学-选修2化学与技术】查看答案和解析>>
(l)火法炼锌是将闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热到1100~1300℃,使锌蒸馏出来.
①写出火法炼锌的主要反应:焙烧反应:.鼓风炉中可能发生的反应:(任写一个)
②从保护环境和充分利用原料角度看如何处理和利用产生的烟气?
(2)工业上冶炼铝就是电解氧化铝
①冶炼铝的电解槽中的阴极和阳极材料均用石油炼制和煤的干馏产品(填物质名称)
②氧化铝的熔点很高,在铝的冶炼中要加入冰晶石(Na3AlF),其作用是.
③工业上冶炼铝时用的原料是Al2O3,而不是AlCl3,其原因是.
(3)工业上“联合制碱法”中主要反应的化学方程式是.其中的CO2来源于.
(4)磁酸钙是制玻璃的原料之一,工业上制玻璃是在玻璃熔炉中进行,其中反应之一为:CaCO3+SiO2
CaSiO3+CO2↑,若在上述条件下,把1000ag CaCO3和60ag SiO2混合,则生成的CO2在标准状况下的体积为高温 .(用含a的代数式表示). -
科目: 来源: 题型:
【化学--选修2化学与技术】查看答案和解析>>
侯德榜制碱法,也叫联合制碱法,其生产流程可简要表示如下图: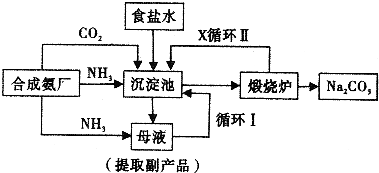
(1)向沉淀池中通入CO2和氨气时,应先通入.原因是.
(2)沉淀池中发生反应的化学反应方程式是;煅烧炉中发生的化学反应方程是.
(3)向母液中通氨气并加入细小食盐颗粒,冷却析出的副产品是,通入氨气的作用是(填选项)
A.增大NH+4的浓度:使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)为提高原料氯化钠的利用率,主要是设计了.(填上述流程中的编号)的循环,物质X是.从沉淀池中分离沉淀的操作是.
(5)CO2是制碱工业的重要原料,侯德耪制碱法和氨碱法中CO2的来源有何不同.
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为. -
科目: 来源: 题型:
【化学选修2-化学与技术】查看答案和解析>>
工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式为.
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是(填化学式),原因是.
(3)通入C和D气体后发生反应的化学方程式是.
(4)④过滤后,向滤液中通入氨气,加入细小食盐颗粒,析出副产品(填化学式),通氨气与加入细小食盐颗粒的作用是.
(5)写出⑤煅烧发生反应的化学方程式:.产品纯碱中含有碳酸氢钠.若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数ω(NaHCO3)=(注明表达式中所用的有关符号的含义).
相关试题

