【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创。某中学科研小组根据该原理设计如下装置图进行相关实验,装置C中CuO的质量为8.0g。
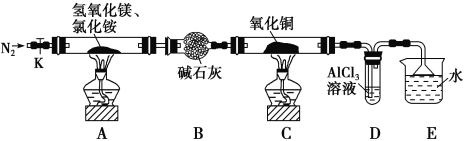
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:______________。
(2)装置D中生成沉淀,发生反应的离子方程式为___________________。
(3)反应过程中持续通入N2的作用有两点:一是:将装置A中产生的氨气完全导出,二是:_______________________。
(4)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,该反应中转移电子的物质的量为_______mol。
(5)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+=Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液
实验步骤 | 预期现象和结论 |
步骤1:取反应后装置C中的少许固体于试管中 | |
步骤2:______________________________ | _____________________ |
【答案】Mg(OH)2+NH4Cl=MgOHCl+NH3↑+H2O Al3++3NH3H2O=Al(OH)3 ↓+3NH4+ 防止倒吸 0.15 向试管中加入2mol/LH2SO4溶液 溶液中出现蓝色,说明红色固体中含有Cu2O
【解析】
利用氢氧化镁和氯化铵加热分解制氨气并得到碱式氯化镁(MgOHCl),为了使反应产生的氨气完全导出并被稀硫酸充分吸收,并还能防止装置D中的氯化铝溶液倒吸入装置C,反应过程中持续通入N2,氨气极易溶于水,碱石灰吸收水蒸汽,可以用碱石灰来干燥氨气,氨水可以和氯化铝之间反应生成氢氧化铝,氨气的尾气处理用水吸收;
(1)根据题目信息:利用氢氧化镁、氯化铵加热分解制氨气并得到碱式氯化镁(MgOHCl)来书写化学方程式即可;
(2)氨水和氯化铝反应生成氯化铵和氢氧化铝,据此写出发生反应的离子方程式;
(3)根据氮气性质稳定实验过程中不与其它物质间产生任何化学反应以及气体压强变化原理来回答;
(4)红色物质为Cu或Cu2O或二者混合物,固体质量减少质量为减少的氧元素质量,再计算CuO中氧元素质量,可以判断红色固体的组成,根据Cu元素守恒、红色固体总质量计算组成物质的量,进而计算转移电子;
(5)Cu能与浓硫酸反应,应用稀H2SO4溶液溶解,溶液中出现蓝色,说明红色固体中含有Cu2O。
(1)根据题意:利用氢氧化镁、氯化铵混合加热,发生反应制得氨气、碱式氯化镁(MgOHCl)、H2O,发生的反应为:Mg(OH)2+NH4Cl![]() MgOHCl+NH3↑+H2O;
MgOHCl+NH3↑+H2O;
(2)氨水和氯化铝反应生成氯化铵和氢氧化铝,反应的离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(3)由于氨气是极易溶于水的,反应过程中持续通入N2,可以使反应产生的氨气完全导出并被水充分吸收,并还能稀释氨气,防止装置D中的氯化铝溶液倒吸入装置C;
(4)红色物质为Cu或Cu2O或二者混合物,固体质量减少质量为减少的氧元素质量,则减少的氧元素质量为8g-6.8g=1.2g,而CuO中氧元素质量为8.0g×![]() =1.6g>1.2g,故红色固体为Cu、Cu2O混合物,设二者物质的量分别为xmol、ymol,则:x+2y=
=1.6g>1.2g,故红色固体为Cu、Cu2O混合物,设二者物质的量分别为xmol、ymol,则:x+2y=![]() ;64x+144y=6.8,解得x=0.05,y=0.025,则转移电子为0.05mol×2+0.025mol×2=0.15mol;
;64x+144y=6.8,解得x=0.05,y=0.025,则转移电子为0.05mol×2+0.025mol×2=0.15mol;
(5)Cu能与浓硫酸反应,Cu2O能与稀酸反应得到Cu2+,用稀H2SO4溶液溶解,溶液中出现蓝色,说明红色固体中含有Cu2O。

