【题目】下列有关溶液组成描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH4+、Cl-、Cu2+
B.中性溶液中可能大量存在Na+、K+、Cl-、SO42-
C.酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
D.强碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
参考答案:
【答案】B
【解析】
A.Cu2+为蓝色,与无色不符,选项A错误;
B. 中性溶液中Na+、K+、Cl-、SO42-相互之间不反应,能大量共存,选项B正确;
C. 酸性溶液中ClO-与I-因发生氧化还原反应而不能大量共存,选项C错误;
D. 强碱性溶液中OH-与HCO3-反应而不能大量共存,选项D错误;
答案选B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】向BaCl2溶液中通入SO2将溶液分置于两支试管中,向一份中加入NaOH溶液,出现白色沉淀A,另一份通入少量Cl2 , 产生白色沉淀B,试回答下列问题:
(1)若不考虑SO2与水的反应向BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”.此处应为 , 原因是 .
(2)沉淀A的化学式为 , 该沉淀能否溶于稀盐酸? .
(3)写出生成沉淀B的离子方程式: .
(4)生成2.33 g沉淀B,需消耗标准状况下的Cl2mL. -
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学变化中,需加入氧化剂才能实现的是
A. CuO→Cu B. C→CO2 C. H2SO4→BaSO4 D. CO2→CO
-
科目: 来源: 题型:
查看答案和解析>>【题目】“钴酞菁(分子直径1.3×10–9m)”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似,我国科学家在世界上第一次为“钴酞菁”分子恢复了磁性。下列关于“钴酞菁”的说法正确的是
A.在水中形成的分散系属于悬浊液
B.在水中形成的分散系属于胶体
C.分子直径比Na+小
D.“钴酞菁”分子既能透过滤纸,也能透过半透膜
-
科目: 来源: 题型:
查看答案和解析>>【题目】氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用。
(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol。
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线_____。
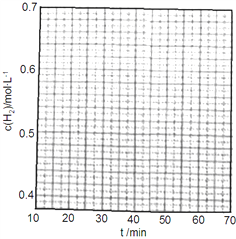
②该反应体系未达到平衡时,催化剂对逆反应速率的影响是_____(填增大、减少或不变)。
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式______________________。
②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10-6,则0.01 mol·L-1 N2H4水溶液的pH等于__________(忽略N2H4的二级电离和H2O的电离)。
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g) ΔH1
2H2(g)+O2(g)=2H2O(l) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(I) ΔH4
则N2H4(l)的标准燃烧热ΔH=_______。
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸。

实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】对于平衡体系mA (g) +nB (g) ==C (g) +gD (g);△H <0,下列结论中错误的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m: n
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承取滴露。”这里所用的“法”是指
A. 萃取 B. 过滤 C. 蒸馏 D. 干馏
相关试题

