【题目】高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
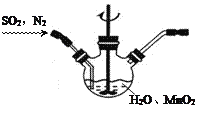
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如右图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2![]() MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
A.MnO2加入前先研磨
B.搅拌
C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓) ![]() 2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)
2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)
![]()
![]()
![]()
![]()
![]()
![]()
![]()
③若用空气代替N2进行实验,会对实验中的SO2利用率_______(选填“增大、无影响、减小”)。
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有________。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):________。
(已知NiCO3为难溶于水的浅绿色固体)
参考答案:
【答案】 AB abef 减小 水、盐酸酸化的BaCl2溶液、乙醇 向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色。
【解析】试题分析:(1)①根据影响反应速率的因素分析;②Na2SO3+2H2SO4(浓) ![]() 2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理;③氧气能氧化SO2;(2)步骤②为洗涤沉淀、验证洗涤是否干净,根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”分析所需试剂;(3)一种沉淀容易转化为比它更难溶的沉淀;
2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理;③氧气能氧化SO2;(2)步骤②为洗涤沉淀、验证洗涤是否干净,根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”分析所需试剂;(3)一种沉淀容易转化为比它更难溶的沉淀;
解析:(1)①A.MnO2加入前先研磨,增大接触面积,加快反应速率,故A正确; B.搅拌加快反应速率,故B正确; C.提高混合气中N2比例,H2SO3浓度降低,反应速率减慢,故C错误;②Na2SO3+2H2SO4(浓) ![]() 2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理,所以应选择的装置有abef;③氧气能氧化SO2,所以空气代替N2进行实验,实验中的SO2利用率减小;(2)根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”,先用蒸馏水洗涤,用盐酸酸化的BaCl2溶液验证洗涤是否干净,再用乙醇洗涤,所以所需试剂是水、盐酸酸化的BaCl2溶液、乙醇;(3)向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色,可证明KSP(MnCO3) < KSP(NiCO3)。
2NaHSO4+SO2↑+H2O反应不需要加热,选用b装置制取SO2;选用e装置使SO2、N2充分混合并控制气体的流速;选用f装置进行尾气处理,所以应选择的装置有abef;③氧气能氧化SO2,所以空气代替N2进行实验,实验中的SO2利用率减小;(2)根据“MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化”,先用蒸馏水洗涤,用盐酸酸化的BaCl2溶液验证洗涤是否干净,再用乙醇洗涤,所以所需试剂是水、盐酸酸化的BaCl2溶液、乙醇;(3)向少量NiSO4溶液中滴加几滴Na2CO3溶液,生成浅绿色沉淀,再滴加足量MnSO4溶液,沉淀变成白色,可证明KSP(MnCO3) < KSP(NiCO3)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、
②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1 硝酸银溶液中,
其中Ag+浓度最小的是____________。(填序号)
(2)电解氯化钠可以得到多种化工原料。用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO
 等杂质。某次除杂操作时,往粗盐水中先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。某次除杂操作时,往粗盐水中先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。
,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。 -
科目: 来源: 题型:
查看答案和解析>>【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D、E为无色气体,C能使湿润的红色石蕊试纸变蓝,B常温下为无色液体,Fe遇浓的G溶液钝化。

(1)写出下列各物质的化学式:
B:____________;F:____________;G:___________。
(2)写出下列变化的反应方程式:
A→D:________________________________________;
G→E:________________________________________。
(3)实验室里,常用加热_____________________的混合物的方法制取气体C,常采用____________法来收集。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
 CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A. ①② B. ①③ C. ②④ D. ③④
-
科目: 来源: 题型:
查看答案和解析>>【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:

(1)用(NH4)2SO4与NH3·H2O的混合溶液浸取锌焙砂生成[Zn(NH3)4]2+的过程中加入H2O2的目的是________。
(2)加入(NH4)2S除杂过程中的主要离子方程式为________。
(3)过滤3所得滤液可循环使用,其主要成分的化学式是_______。
(4)检验2Zn(OH)2·ZnCO3沉淀是否洗涤干净的方法是________。
(5)写出沉锌步骤中发生反应的化学方程式________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是( )
A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D. 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生

相关试题

