2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年同步练习册人民教育出版社高中化学选择性必修第一册人教版B山东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第115页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
【例】为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验的分析不正确的是(
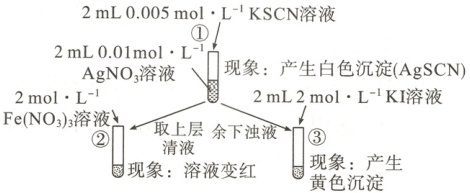
A.①浊液中存在平衡:AgSCN(s)⇌Ag⁺(aq)+SCN⁻(aq)
B.②中颜色变化说明上层清液中含有SCN⁻
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
D
)。
A.①浊液中存在平衡:AgSCN(s)⇌Ag⁺(aq)+SCN⁻(aq)
B.②中颜色变化说明上层清液中含有SCN⁻
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
答案:
D 解析$0.01\ mol · L^{-1}\ AgNO_3$溶液中加入 $0.005\ mol · L^{-1}\ KSCN$溶液,产生白色沉淀$AgSCN$,该沉 淀在溶液中存在沉淀溶解平衡:$AgSCN(s) \longrightarrow Ag^+(aq) +$ $SCN^-(aq)$,A项正确。取①上层清液加入$2\ mol · L^{-1}$ $Fe(NO_3)_3$溶液,溶液变成红色,说明有$Fe(SCN)_3$生成, 从而推知上层清液中含有$SCN^-$,B项正确。①中余下浊 液中加入$2\ mol · L^{-1}\ KI$溶液,产生黄色沉淀,该沉淀应 为$AgI$,C项正确。①中反应后$AgNO_3$溶液有剩余,则余下 浊液中除含有$AgSCN$外,还有$AgNO_3$,再加入$2\ mL$ $2\ mol · L^{-1}\ KI$溶液生成$AgI$沉淀,不能说明$AgSCN$转化 为$AgI$,故不能证明$AgI$比$AgSCN$更难溶,D项错误。
对点训练
某些离子的氢氧化物溶度积常数(25℃)如表所示。

(1) 常温下,要除去0.1mol·L⁻¹ZnSO₄溶液中混有的Fe³⁺,可以通过调节溶液的pH来实现,试通过计算确定,当调节溶液的pH为_时可认为Fe³⁺沉淀完全。
(2) 常温下,除去ZnSO₄溶液中混有的Fe²⁺,可先加入_,再加入_,并调节溶液的pH即可。
某些离子的氢氧化物溶度积常数(25℃)如表所示。

(1) 常温下,要除去0.1mol·L⁻¹ZnSO₄溶液中混有的Fe³⁺,可以通过调节溶液的pH来实现,试通过计算确定,当调节溶液的pH为_时可认为Fe³⁺沉淀完全。
(2) 常温下,除去ZnSO₄溶液中混有的Fe²⁺,可先加入_,再加入_,并调节溶液的pH即可。
2.8 ≤ pH < 6
H₂O₂
答案:
(1)$2.8 \leqslant pH<6$
(2)$H_2O_2$(答案 合理即可,下同) $ZnO$ 解析
(1)$Fe^{3+}$恰好沉淀完全时,$K_sp[Fe(OH)_3] =$ $c(Fe^{3+}) · c^3(OH^-) = 1 × 10^{-5} · c^3(OH^-) = 2.8 × 10^{-39}$, 则$c(OH^-) = \sqrt[3]{\frac{2.8 × 10^{-34}}{1}}\ mol · L^{-1} \approx 6.54 × 10^{-12}$ $mol · L^{-1}$,$c(H^+) = \frac{K_w}{c(OH^-)} = \frac{1 × 10^{-14}}{6.54 × 10^{-12}}\ mol · L^{-1} \approx$ $1.54 × 10^{-3}\ mol · L^{-1}$,$pH = -\lg c(H^+) = -\lg 1.54 ×$ $10^{-3} \approx 2.8$;$Zn^{2+}$开始沉淀时,$K_sp[Zn(OH)_2] = c(Zn^{2+}) ·$ $c^2(OH^-) = 10^{-1} · c^2(OH^-) = 1.2 × 10^{-17}$,$c(OH^-) \approx 1.1 ×$ $10^{-8}\ mol · L^{-1}$,$c(H^+) = \frac{K_w}{c(OH^-)} \approx 9.1 × 10^{-7}\ mol · L^{-1}$, $pH \approx 6$。即调节溶液的pH为$2.8 \leqslant pH<6$时,$Fe^{3+}$沉淀完全。
(2)先加入氧化剂如$H_2O_2$把$Fe^{2+}$氧化成$Fe^{3+}$,再加 入$ZnO$调节溶液的pH大于2.8。
(1)$2.8 \leqslant pH<6$
(2)$H_2O_2$(答案 合理即可,下同) $ZnO$ 解析
(1)$Fe^{3+}$恰好沉淀完全时,$K_sp[Fe(OH)_3] =$ $c(Fe^{3+}) · c^3(OH^-) = 1 × 10^{-5} · c^3(OH^-) = 2.8 × 10^{-39}$, 则$c(OH^-) = \sqrt[3]{\frac{2.8 × 10^{-34}}{1}}\ mol · L^{-1} \approx 6.54 × 10^{-12}$ $mol · L^{-1}$,$c(H^+) = \frac{K_w}{c(OH^-)} = \frac{1 × 10^{-14}}{6.54 × 10^{-12}}\ mol · L^{-1} \approx$ $1.54 × 10^{-3}\ mol · L^{-1}$,$pH = -\lg c(H^+) = -\lg 1.54 ×$ $10^{-3} \approx 2.8$;$Zn^{2+}$开始沉淀时,$K_sp[Zn(OH)_2] = c(Zn^{2+}) ·$ $c^2(OH^-) = 10^{-1} · c^2(OH^-) = 1.2 × 10^{-17}$,$c(OH^-) \approx 1.1 ×$ $10^{-8}\ mol · L^{-1}$,$c(H^+) = \frac{K_w}{c(OH^-)} \approx 9.1 × 10^{-7}\ mol · L^{-1}$, $pH \approx 6$。即调节溶液的pH为$2.8 \leqslant pH<6$时,$Fe^{3+}$沉淀完全。
(2)先加入氧化剂如$H_2O_2$把$Fe^{2+}$氧化成$Fe^{3+}$,再加 入$ZnO$调节溶液的pH大于2.8。
查看更多完整答案,请扫码查看


