第96页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
|加入稀盐酸的质量/$g$|30|30|30|30|30|
|剩余固体的质量/$g$|9|6|3|2|2|
计算:(1)此石灰石中碳酸钙的质量分数是多少?(结果精确到$0.1\%$)(2)生成气体的质量是多少?7. 某治疗胃酸过多的药片的主要成分为碳酸氢钠(含少量碳酸钠)。为了测定药片中碳酸氢钠的含量,将药片研碎,取$4.0\ g$样品加热到质量不再减少时,收集到的气体经干燥后质量为$0.88\ g$。(碳酸氢钠受热分解的化学方程式:$2NaHCO_3 \xlongequal{\triangle} Na_2CO_3 + H_2O + CO_2 \uparrow$,样品中其他成分受热不分解)(1)碳酸钠中钠、碳、氧三种元素的质量比是______(最简整数比)。(2)计算该样品中碳酸氢钠的质量分数。
|剩余固体的质量/$g$|9|6|3|2|2|
计算:(1)此石灰石中碳酸钙的质量分数是多少?(结果精确到$0.1\%$)(2)生成气体的质量是多少?7. 某治疗胃酸过多的药片的主要成分为碳酸氢钠(含少量碳酸钠)。为了测定药片中碳酸氢钠的含量,将药片研碎,取$4.0\ g$样品加热到质量不再减少时,收集到的气体经干燥后质量为$0.88\ g$。(碳酸氢钠受热分解的化学方程式:$2NaHCO_3 \xlongequal{\triangle} Na_2CO_3 + H_2O + CO_2 \uparrow$,样品中其他成分受热不分解)(1)碳酸钠中钠、碳、氧三种元素的质量比是______(最简整数比)。(2)计算该样品中碳酸氢钠的质量分数。
答案:
6.
(1)由表可知,最终剩余固体的质量为 2 g,故混合物中碳酸钙的质量为 12 g-2 g=10 g,故样品中碳酸钙的质量分数为$\frac{10\ g}{12\ g}$×100%≈83.3%。答:此石灰石中碳酸钙的质量分数是 83.3%。
(2)设:生成气体的质量为 x。CaCO₃+2HCl$\xlongequal{}$CaCl₂+H₂O+CO₂↑100 4410 g x$\frac{100}{44}=\frac{10\ g}{x}$ x=4.4 g答:生成气体的质量为 4.4 g。7.
(1)23∶6∶24
(2)[解]设:该样品中碳酸氢钠的质量为 x。2NaHCO₃$\xlongequal{\triangle}$Na₂CO₃+H₂O+CO₂↑168 44x 0.88 g$\frac{168}{44}=\frac{x}{0.88\ g}$ x=3.36 g该样品中碳酸氢钠的质量分数为$\frac{3.36\ g}{4.0\ g}$×100%=84%。答:该样品中碳酸氢钠的质量分数为 84%。
(1)由表可知,最终剩余固体的质量为 2 g,故混合物中碳酸钙的质量为 12 g-2 g=10 g,故样品中碳酸钙的质量分数为$\frac{10\ g}{12\ g}$×100%≈83.3%。答:此石灰石中碳酸钙的质量分数是 83.3%。
(2)设:生成气体的质量为 x。CaCO₃+2HCl$\xlongequal{}$CaCl₂+H₂O+CO₂↑100 4410 g x$\frac{100}{44}=\frac{10\ g}{x}$ x=4.4 g答:生成气体的质量为 4.4 g。7.
(1)23∶6∶24
(2)[解]设:该样品中碳酸氢钠的质量为 x。2NaHCO₃$\xlongequal{\triangle}$Na₂CO₃+H₂O+CO₂↑168 44x 0.88 g$\frac{168}{44}=\frac{x}{0.88\ g}$ x=3.36 g该样品中碳酸氢钠的质量分数为$\frac{3.36\ g}{4.0\ g}$×100%=84%。答:该样品中碳酸氢钠的质量分数为 84%。
学习小组开展了“设计和制作简易供氧器”的实践活动。
某品牌制氧机的制氧剂为二氧化锰和过碳酸钠(化学式$2{Na_{2}CO_{3}}·3{H_{2}O_{2}}$,白色固体,是过氧化氢与碳酸钠的加合物,遇水后能产生氧气)。
【活动一】认识制氧机。
(1)观察窗的作用是______。
(2)加湿仓的作用是______。
【活动二】探究制氧过程。
(3)Ⅰ.反应原理探究。
|实验操作|现象|结论|
|向锥形瓶a中加入1.5g过碳酸钠|分别加入100mL蒸馏水,观察;将一根带火星的木条伸入锥形瓶内,用手触摸锥形瓶外壁|瓶中有少许气泡产生;带火星木条不复燃;瓶壁不发烫|使用过碳酸钠制氧气,需要加入二氧化锰固体;该反应是放热反应|
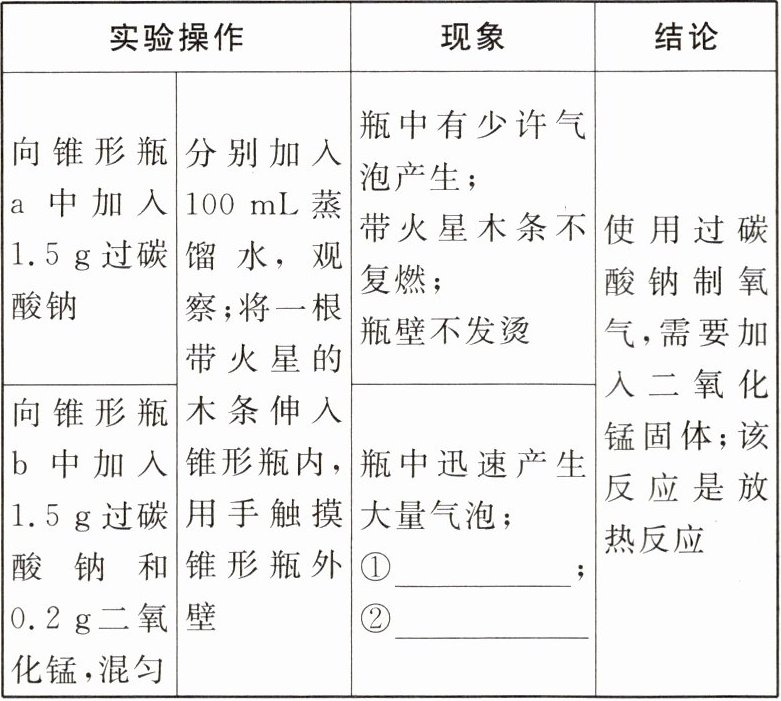
|向锥形瓶b中加入1.5g过碳酸钠和0.2g二氧化锰,混匀|瓶中迅速产生大量气泡;①______;②______|
(4)小组同学向反应后的锥形瓶b中重复多次加入1.5g过碳酸钠,混匀后均又出现上述现象,反应后将剩余固体过滤、洗净、干燥、称量,固体质量仍为0.2g,则${MnO_{2}}$在此反应中作______。
Ⅱ.制氧剂的选择。
小组同学想到过氧化氢溶液常温下也可以快速制氧,为什么不选用过氧化氢溶液而选用过碳酸钠呢?于是该兴趣小组对两者的制氧效率进行探究,并筛选合适的制氧剂。
【查阅资料】
常温常压下产生150mL的氧气,以5%的过氧化氢溶液为制氧剂需要9.1mL;以过碳酸钠为制氧剂需要1.4g。
【实验方案】
(5)利用如图2装置设计如下实验,并记录0~20min量筒中水的体积。
|实验|锥形瓶中试剂|注射器中试剂|
|实验1|0.2g二氧化锰|9.1mL 5%过氧化氢溶液|
|实验2|1.4g过碳酸钠和0.2g二氧化锰|______mL水|
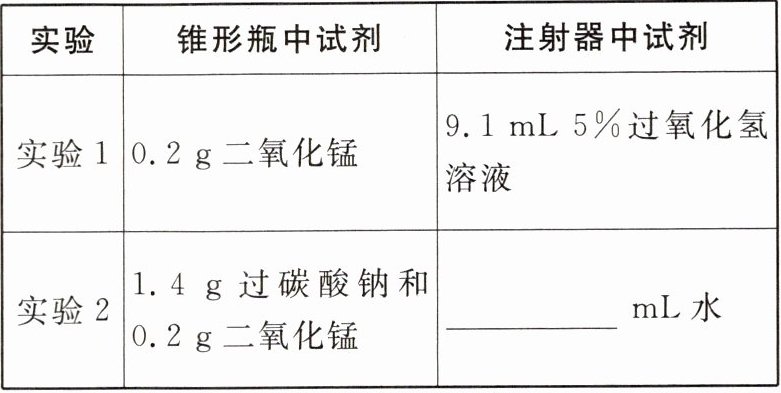
(6)实验1中反应的化学方程式为______。
Ⅲ.加水量的探究。
往锥形瓶中加入1.4g过碳酸钠、0.2g${MnO_{2}}$和9.1mL水,再分别用不同体积的水进行实验。记录并处理20min内数据如图3。
(7)由图3可得出的结论是______。
【活动三】制作供氧器。
(8)结合图4中数据,制氧剂选择过碳酸钠的依据是______。
(9)学习小组利用身边物品自制了如图5的简易供氧器,与真实产品相比,形成的观点不正确的是______(填字母)。
A.产氧和洗气装置组合不用一体化
B.内部气体流向采用高进低出方式
C.特定需求是选择制氧方法的重要依据
D.制氧机要符合美学、工程、安全等标准
某品牌制氧机的制氧剂为二氧化锰和过碳酸钠(化学式$2{Na_{2}CO_{3}}·3{H_{2}O_{2}}$,白色固体,是过氧化氢与碳酸钠的加合物,遇水后能产生氧气)。
【活动一】认识制氧机。
(1)观察窗的作用是______。
(2)加湿仓的作用是______。
【活动二】探究制氧过程。
(3)Ⅰ.反应原理探究。
|实验操作|现象|结论|
|向锥形瓶a中加入1.5g过碳酸钠|分别加入100mL蒸馏水,观察;将一根带火星的木条伸入锥形瓶内,用手触摸锥形瓶外壁|瓶中有少许气泡产生;带火星木条不复燃;瓶壁不发烫|使用过碳酸钠制氧气,需要加入二氧化锰固体;该反应是放热反应|

|向锥形瓶b中加入1.5g过碳酸钠和0.2g二氧化锰,混匀|瓶中迅速产生大量气泡;①______;②______|
(4)小组同学向反应后的锥形瓶b中重复多次加入1.5g过碳酸钠,混匀后均又出现上述现象,反应后将剩余固体过滤、洗净、干燥、称量,固体质量仍为0.2g,则${MnO_{2}}$在此反应中作______。
Ⅱ.制氧剂的选择。
小组同学想到过氧化氢溶液常温下也可以快速制氧,为什么不选用过氧化氢溶液而选用过碳酸钠呢?于是该兴趣小组对两者的制氧效率进行探究,并筛选合适的制氧剂。
【查阅资料】
常温常压下产生150mL的氧气,以5%的过氧化氢溶液为制氧剂需要9.1mL;以过碳酸钠为制氧剂需要1.4g。
【实验方案】
(5)利用如图2装置设计如下实验,并记录0~20min量筒中水的体积。
|实验|锥形瓶中试剂|注射器中试剂|
|实验1|0.2g二氧化锰|9.1mL 5%过氧化氢溶液|
|实验2|1.4g过碳酸钠和0.2g二氧化锰|______mL水|

(6)实验1中反应的化学方程式为______。
Ⅲ.加水量的探究。
往锥形瓶中加入1.4g过碳酸钠、0.2g${MnO_{2}}$和9.1mL水,再分别用不同体积的水进行实验。记录并处理20min内数据如图3。
(7)由图3可得出的结论是______。
【活动三】制作供氧器。
(8)结合图4中数据,制氧剂选择过碳酸钠的依据是______。
(9)学习小组利用身边物品自制了如图5的简易供氧器,与真实产品相比,形成的观点不正确的是______(填字母)。
A.产氧和洗气装置组合不用一体化
B.内部气体流向采用高进低出方式
C.特定需求是选择制氧方法的重要依据
D.制氧机要符合美学、工程、安全等标准
答案:
(1)观察是否有气泡产生和产生气泡的快慢
(2)洗气,使氧气具有一定的湿度
(3)①带火星木条复燃 ②瓶壁发烫
(4)催化剂
(5)9.1
(6)$2\mathrm{H}_{2}\mathrm{O}_{2}\xlongequal{\mathrm{MnO}_{2}}2\mathrm{H}_{2}\mathrm{O}+\mathrm{O}_{2}\uparrow $
(7)过碳酸钠的产氧速率随加水量的增加而增大
(8)相同条件下,2~20 min 内,过碳酸钠产氧速率比5%过氧化氢溶液的产氧速率高
(9)A
(1)观察是否有气泡产生和产生气泡的快慢
(2)洗气,使氧气具有一定的湿度
(3)①带火星木条复燃 ②瓶壁发烫
(4)催化剂
(5)9.1
(6)$2\mathrm{H}_{2}\mathrm{O}_{2}\xlongequal{\mathrm{MnO}_{2}}2\mathrm{H}_{2}\mathrm{O}+\mathrm{O}_{2}\uparrow $
(7)过碳酸钠的产氧速率随加水量的增加而增大
(8)相同条件下,2~20 min 内,过碳酸钠产氧速率比5%过氧化氢溶液的产氧速率高
(9)A
查看更多完整答案,请扫码查看


